作者简介:
蔡宇(1992-),女,贵州安顺人,医学硕士,住院医师,主要研究方向为肝癌免疫联合靶向治疗。
目的 回顾性分析既往接受过系统治疗后病情进展的中晚期(BLCL分期B/C)肝癌患者使用卡瑞利珠单抗联合安罗替尼治疗的疗效和安全性。方法 收集2019年10月至2021年10月期间在武汉科技大学附属天佑医院和湖北省人民医院病理诊断为原发性肝细胞癌(primary hepatocellular carcinoma,HCC)患者136例,将其分为三组,分别为卡瑞利珠单抗联合安罗替尼治疗组、安罗替尼治疗组、卡瑞丽珠单抗治疗组,定期通过系统评估,采集总生存期(overall survival,OS)、无进展生存期(progression free survival,PFS)、客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)等指标数据,进行疗效评价和不良反应分级;通过卡方检验和生存性分析( P<0.5)方法进行显著性分析。结果 在联合治疗组中,患者中位OS为15.5月,中位PFS为9.5月,ORR为20.5%,DCR为95.2%;治疗相关不良事件(adverse events, AE)主要集中在1~2级,3~4级发生率低于5%;明显优于对照组。结论 卡瑞利珠单抗联合安罗替尼治疗的中晚期HCC患者疗效显著,安全性可控。
Objective To retrospectively analyze the efficacy and safety of camrelizumab combined with anlotinib in patients with intermediate-advanced (BLCL stage B/C) liver cancer who had progressed after systemic therapy.Methods A total of 136 patients who were collected from The Tianyou Hospital Affiliated to Wuhan University of Science and Technology, and Renmin Hospital Affiliated to Wuhan University with pathological diagnosis of primary hepatocellular carcinoma (HCC) from October 2019 to October 2021, and divided into three groups, camrelizumab combined with anlotinib treatment group, anlotinib treatment group, camrelizumab treatment group, through systematic evaluation on a regular basis, collect overall survival (OS), progression-free survival (PFS), objective response rate (ORR), disease control rate (DCR) and other index data for efficacy evaluation and adverse reaction classification; through chi-square test and survival analysis ( P<0.5) method for significance analysis.Results In the combination therapy group, the median OS of patients was 15.5 months, the median PFS was 9.5 months, and the ORR was 20.5%, DCR was 95.2%; treatment-related adverse events (AE) were mainly concentrated in grade 1 and grade 2, and the incidence of grade 3 to grade 4 was less than 5%; obviously better than the control group.Conclusions Camrelizumab combined with anlotinib in the treatment of patients with intermediate-advanced (BLCL stage B/C) primary liver cancer has a significant curative effect and controllable safety.
原发性肝癌(primary hepatocellular carcinoma, HCC)在我国发病率高, 大部分肝癌患者(> 80%)就诊时已经为晚期, 不可手术切除, 放化疗毒副作用较大, 治疗效果欠佳, 生存期短, 预后差[1, 2]。而肝癌经典的治疗方法各有优势和局限, 单独一种治疗方案难以使患者获得较满意的疗效。靶向治疗的药物具有很高的靶向性, 使得部分肝癌患者的生存期获益, 但同时容易产生耐药性。免疫检测点抑制剂的出现使得患者总体生存状况得到一定程度改善, 但是单药治疗有效率明显低于其他方案的治疗效果。因此联合治疗成为了可选的发展方向, 寻求最佳的联合治疗方案成为了广大研究者的目标。
随着程序性死亡受体1(programmed death 1, PD-1)抑制剂在各类实体肿瘤治疗中取得显著效果[3], 分子靶向治疗联合免疫治疗成为了研究热点[4]。本研究收集了136例中晚期肝癌患者, 分为联合治疗组、安罗替尼治疗组、卡瑞丽珠单抗治疗组, 共三组, 探讨肝癌在联合方案治疗过程中的疗效与安全性。
本研究收集了武汉同济天佑医院和湖北省人民医院2019年10月至2021年10月期间经病理学和影像学等明确诊断中晚期原发性肝癌, 而且既往接受过系统治疗后病情进展的患者136例。所有患者按照卡瑞利珠单抗联合安罗替尼治疗组、卡瑞利珠单抗治疗组、安罗替尼治疗组, 共为三组。其中联合组83人, 卡瑞利珠单抗治疗组33人, 安罗替尼治疗组20人, 每组均收集患者的基线情况包括性别、年龄、病理类型、肿瘤分期、a-L-岩藻糖苷酶(a-L-fucosidase, AFU); 疗效情况, 包括总生存期(overall survival, OS)、无进展生存期(progression free survival, PFS)、客观缓解率(objective response rate, ORR)、疾病控制率(disease control rate, DCR), 不良事件情况, 包括发生率、各级别的例数。
1.1.1 纳入标准 ①根据病理学确诊为原发性肝细胞癌患者; ②BCLC分期肿瘤分期为中晚期(BCLC 分期B/C期)患者; ③除肝细胞癌外, 无其他恶性肿瘤及免疫缺陷性疾病; ④住院期间患者采取卡瑞利珠单抗联合安罗替尼方案治疗或卡瑞利珠单抗或安罗替尼治疗; ⑤BCLC分期为B期(中期)患者, 拒绝行经肝动脉栓塞化疗(transarterial chemoembolization, TACE)术等有创治疗, 要求行全身药物治疗的患者。
1.1.2 排除标准 ①影像学诊断或病理学诊断肝转移癌、胆管癌、混合型肝癌患者; ②原发性肝恶性肿瘤, BCLC分期为A期患者; ③有严重肾功能、心脏功能不全及免疫缺陷患者; ④治疗前使用TACE术、放化疗治疗患者。
1.1.3 治疗方法 本研究符合《世界医学协会赫尔辛基宣言》相关要求, 所有患者分为联合治疗组、卡瑞利珠单抗治疗组、安罗替尼治疗组。根据分组分别给予口服安罗替尼(生产厂家:正大天晴药业集团股份有限公司, 8 mg:国药准字号H20180002; 10 mg:国药准字号H20180003; 12 mg:国药准字号H20180004, 生产批号:191223283; 200826283; 201022183; 210615183)治疗, 起始剂量根据患者具体情况给予12 mg/d或10 mg/d或8 mg/d, 连续服用2周, 停药1周, 3周为一个周期。静脉滴注卡瑞利珠单抗(生产厂家:苏州盛迪亚生物医药有限公司, 国药准字号S2O190027, 生产批号:201907002A), 推荐剂量为200 mg/次, 静脉滴注, 每2周1次。治疗持续到病情进展或患者不能耐受, 减量后仍不能耐受, 则治疗终止。联合用药方案为安罗替尼10 mg/d口服qd, d1~d14+卡瑞利珠单抗200 mg 静脉滴注q2w。
疗效评价依据实体肿瘤疗效评价标准(response criteria in solid tumors, RECIST)进行疗效评价。生存率(survival rate)=接受某种治疗的病人或者某病患者, 经若干年随访(通常为1年、3年、5年)后, 尚存活的患者所占的比例。
毒性反应根据2019年中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)免疫检测点抑制剂相关的毒性管理指南分级标准进行分级。靶向药物毒性反应根据2014年美国综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南标准进行分级。
应用SPSS 26.0软件对数据进行处理与分析, 应用t检验方法分析不良事件发生率和疗效显著性(P< 0.05)。应用COX回归分析三组患者的OS及风险之间关系, 评估患者预后。
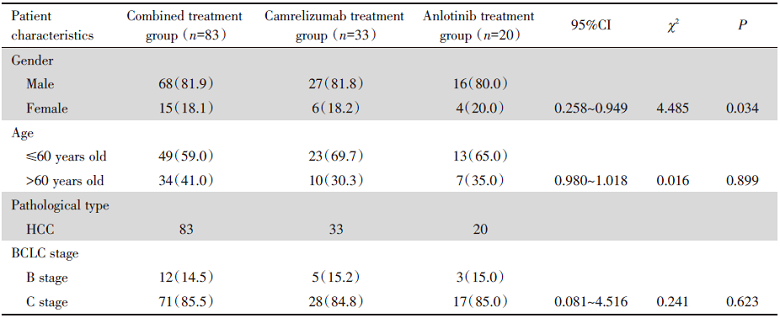
三组患病男性多于女性, 发病年龄集中分布在40岁以上, 平均年龄为56.47± 11.93。患者病理类型为肝细胞癌, BCLC分期主要集中在B/C期, 为中晚期肝癌患者, 其中以晚期为主, 三组基线情况无统计学差异, 见表1。
| 表1 136例中晚期原发性肝癌患者的基线情况 Tab.1 Baseline of 136 patients with intermediate-advanced primary HCC n(%) |
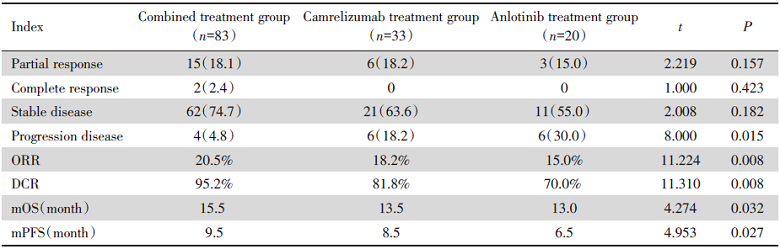
在联合治疗组、安罗替尼治疗组、卡瑞丽珠单抗治疗组的肝癌患者中, 联合组、安罗替尼组、卡瑞丽珠单抗组的ORR分别为20.5%、15.0%、18.2%, DCR分别为95.2%、70.0%、81.8%, 中位PFS均值分别为9.5个月、6.5个月、8.5个月, 中位OS分别为15.5个月、13.0个月、13.5个月, 由此可说明卡瑞利珠单抗联合安罗替尼对中晚期肝癌有较好的疗效, 能明显控制疾病的发展, 提高患者的PFS和OS, 见表2。
| 表2 各治疗组治疗中晚期肝癌疗效分析 Tab.2 Analysis of curative effect of all treatment groups patients with intermediate and advanced primary HCC n(%) |
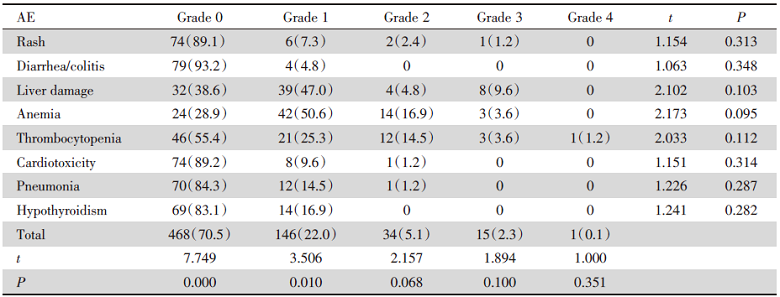
在联合治疗组、安罗替尼治疗组、卡瑞利珠单抗组治疗的肝癌患者中, 出现的治疗相关的不良事件(adverse event, AE)中, 0级发生率分别为70.5%、46.9%、65.5%; 1级发生率分别为22.0%、40.6%、25%; 2级发生率分别为5.1%、8.8%、7.5%; 3级发生率分别为2.3%、3.1%、2.0%; 4级发生率分别为0.1%、0.7%、0%; 2级以下不良反应事件分别为92.5%、87.5%、90.5%, 由此可看出该联合治疗方案治疗过程中出现的AE主要集中在1~2级, 予以对症治疗可明显好转, 严重不良事件发生率较单药组未明显上升, 因此该联合方案对中晚期肝癌有较好安全性, 可耐受, 见表3。
| 表3 卡瑞利珠单抗联合安罗替尼治疗中晚期肝癌不良反应 Tab.3 Analysis of adverse event of camrelizumab combined with anlotinib in patients with intermediate-advanced primary HCC n(%) |
原发性肝癌是威胁人类生命的主要因素之一, 既往常规治疗的毒副反应使患者难以获益[5]。靶向药物不断问世, 为晚期肝癌的治疗带来了多种选择[6]。安罗替尼作为新型靶向药物, 此前研究显示, 安罗替尼在晚期肺癌治疗中有显著疗效[7, 8, 9]。随后Sun等Ⅱ 期临床试验表明靶向药物安罗替尼作为晚期肝癌的一线或者二线治疗有效而且安全可控[10, 11]。靶向药物治疗起效快, 但是目前面临的挑战是耐药性的产生使其治疗效果受到影响[12]。
目前受到研究者关注的PD-1/程序性死亡配体1(programmed death ligand 1, PD-L1)抑制剂免疫治疗也成为了治疗肝癌的重要方法, 既往关于MEDI4736的Ⅰ 、Ⅱ 期临床试验和CheckMate 040研究证明抗PD-1及抗PD-L1抗体在晚期肝癌的治疗中有较好的疗效及安全性[13, 14]。免疫治疗效果较好, 然而其起效慢, 一般3~4个月才起效, 提示联合治疗成为肝癌中晚期首选的治疗方案。
近年来相关研究表明分子靶向治疗联合免疫治疗方案能明显延长中晚期肝癌患者生存期, 提高患者疾病控制率, 降低不良反应[15, 16, 17, 18, 19, 20], 其ORR可高达60%, DCR为93.3%[21], 明显高于其他联合方案。近期研究显示靶向药物安罗替尼联合PD-1抑制剂治疗晚期实体瘤有效而且安全性可控[22, 23]。
我们的研究也证实了在既往接受系统治疗后病情进展后予以免疫联合靶向治疗中晚期肝癌具有较好疗效和安全性, 首次回顾性分析了安罗替尼联合卡瑞利珠单抗治疗组与单药卡瑞利珠单抗治疗组或者安罗替尼治疗组相比可明显延长患者mOS(mOS分别为15.5个月vs. 13.0个月 vs. 13.5个月)、mPFS(9.5个月vs. 6.5个月 vs. 8.5个月), 疾病控制率高达95.2%。
该研究首次通过分析联合组(即卡瑞利珠单抗联合安罗替尼)与对照组的AE发生率, 联合治疗组可降低患者AE, 2级以下不良反应事件分别为92.5% vs. 87.5% vs. 90.5%, 提示联合组治疗具有良好安全性。
综上, 我们通过分析使用卡瑞利珠单抗联合安罗替尼与单药治疗对照组分别治疗的中晚期(BCLC分期B/C)肝癌患者, 结果显示该联合方案作为既往进行系统治疗进展后的中晚期肝癌患者的二线治疗具有显著治疗效果, 其治疗相关不良事件发生率低, 安全性好。该研究结果对临床肝癌治疗方案选择提供证据支持。
但目前在晚期肝癌全身治疗中, 具体哪种治疗组合的疗效最佳尚处于临床研究中。最近一项安罗替尼联合派安普利单抗一线治疗不可切除肝细胞癌的Ⅰ b/Ⅱ 期研究联合组ORR为31.0%, DCR为82.8%, mPFS为8.8个月, mOS尚未达到, 所有级别不良反应的发生率为90.3%, 3级及以上不良反应的发生率为19.4%[24]。目前Ⅲ 期研究(ALTN-AK105-Ⅲ -02)正在进行中。未来需要进一步深入研究, 探求对晚期肝癌患者获益最大的治疗方案, 以期改善患者生存质量并延长生存期。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|