作者简介:
刘思阳(1992-),女,回族,黑龙江双鸭山人,助理研究员,医学博士,从事晚期肺癌免疫治疗研究;周清(1976-),女,汉族,河北徐水人,主任医师,医学博士,从事晚期肺癌靶向治疗研究。刘思阳和周清为共同第一作者。
双特异性抗体具有两种不同抗原结合位点,可结合两个不同抗原或同一抗原的两个不同抗原表位,相较于常见的单特异性抗体,双特异性抗体具有提升抗肿瘤效果、不良反应小和抗体用量少的特点。肺癌是双特异性抗体研究重点关注的疾病领域之一,amivantamab的出现和获批上市为患者提供了新的选择。本文对肿瘤治疗领域的双特异性抗体药物特性和肺癌领域双特异性抗体研究进展进行综述,为肺癌的临床治疗提供新思路。
Bispecific antibody refers to an antibody that can bind to different types of antigens or two different epitopes on the same antigen. Therefore, compared to monospecific antibodies, bispecific antibodies are characterized by enhanced anti-tumor effects, low adverse effects and low antibody dosage. Lung cancer is one of the main study populations for bispecific antibodies, and the advent and approval of amivantamab to market provides a new option for the treatment of lung cancer patients. This paper reviewed the characteristics of bispecific antibodies in tumor therapy and the research progress of bispecific antibodies in lung cancer, so as to provide some new ideas for the clinical treatment of lung cancer.
双特异性抗体(bispecific antibody)指含有两种不同抗原结合位点, 一个抗体分子可与两个不同抗原或同一抗原的两个不同抗原表位相结合的抗体[1], 可用于肿瘤等疾病治疗。常见的单特异性抗体只能结合一种抗原, 而双特异性抗体不仅可结合两种抗原或两个不同抗原表位, 其对应的两种抗肿瘤机制还可以相互作用产生协同效应[2]。双特异性抗体除了提升抗肿瘤效果, 还能降低抗体用量, 从而降低不良反应风险。全球首个双特异抗体药物catumaxomab, 可同时靶向肿瘤细胞表面的上皮细胞粘附因子(epithelial cell adhesion factor, EpCAM)与T细胞表面CD3抗原, 于2009年被欧盟批准上市应用于结直肠癌恶性腹水的治疗。近年来, 越来越多的双特异性抗体在肿瘤治疗领域开展探索, 除了已经获批上市的三款双特异性抗体外, 还有众多双特异性抗体正处于上市前新药临床试验阶段。
肺癌是中国发病率和死亡率最高的恶性肿瘤, 约85%的肺癌为非小细胞肺癌(non-small cell lung cancer, NSCLC)[3]。2022年中国由肺癌导致的死亡人数预计达到76.7万, 肺癌将是导致癌症相关死亡的首要病因[4]。NSCLC的发生发展常与致癌驱动基因突变相关。随着肺癌驱动基因的发现及致病机制的深入研究, NSCLC靶向治疗取得快速发展, 患者生存率大大提高。目前, 靶向不同基因突变的酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)已成为NSCLC最常见的靶向治疗药物类型之一。单抗类药物在肺癌治疗方面同样发挥着重要作用, 免疫检查点抑制剂(immune checkpoint inhibitor, ICI)不针对特定的肿瘤信号传导通路蛋白, 而是基于免疫系统对肿瘤细胞的抑制作用[5]; 抗血管靶向药物, 如贝伐珠单抗通过抑制血管内皮细胞增殖和活化, 从而发挥抗血管生成和抗肿瘤作用[6]。然而, 单抗单药治疗容易发生原发性和继发性耐药[7], 而联合治疗在增加疗效的同时也增加了不良事件的风险[8]。联合靶向肿瘤细胞上表皮生长因子受体(epidermal growth factor receptor, EGFR)和细胞间质上皮转换因子(c-mesenchymal-epithelial transition factor, c-Met)的双特异性抗体amivantamab作为一款靶向治疗药物, 其获批上市为NSCLC治疗提供了新策略。本文将介绍双特异性抗体的抗肿瘤特性及其在肺癌中的应用。
1.1.1 靶点组合策略
双特异性抗体结合的抗原靶点主要为分布在肿瘤细胞、免疫细胞的膜表面蛋白和肿瘤微环境中的细胞因子等。根据双特异性抗体的靶点组合策略不同, 大致可以将抗体分为以下四种(图1):
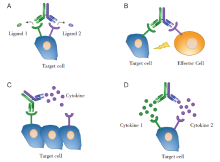 | 图1 根据双特异性抗体靶点组合策略不同进行分型Fig.1 Bispecific antibody classification by different target combination strategies |
1.1.1.1 靶向同一细胞的两种不同的蛋白抗原 这一类别下还可分为以下3种亚型:(1)双特异性抗体可以同时靶向细胞上的两种不同受体, 阻断两条细胞信号传导通路(图1A), 例如联合靶向肿瘤细胞表面EGFR和c-Met的amivantamab[9], 用于治疗晚期NSCLC; (2)同时靶向肿瘤细胞的两种不同的表面抗原, 比如联合靶向CD20和人类白细胞DR抗原(human leukocyte antigen DR, HLA-DR)的CD20-HLA-DR DVD-Ig, 能有效提高抗体特异性, 降低对非肿瘤细胞的杀伤作用, 用于治疗B细胞淋巴瘤特别是CD20+HLR-DR+的非霍奇金淋巴瘤[10]; (3)靶向同一个靶点的两个非重叠抗原表位, 比如靶向人表皮生长因子受体-2(human epidermal growth factor receptor 2, HER2)的zanidatamab(ZW25), 能够增加抗体结合密度、提高效应细胞功能, 用以治疗HER2阳性的癌症[11], 包括乳腺癌、胃/胃食管交界处腺癌等[12]。
1.1.1.2 联合靶向肿瘤细胞和免疫细胞 此类双特异性抗体的两个靶点一个位于肿瘤细胞表面, 而另一个位于免疫细胞表面(图1B)。如靶向肿瘤细胞表面的EpCAM与T细胞表面CD3抗原的catumaxomab, 可以通过T细胞释放的穿孔素和颗粒酶B介导肿瘤细胞的裂解, 直接杀伤肿瘤细胞, 治疗恶性肿瘤腹膜转移导致的恶性腹水[13]; 双特异性抗体如KN046还可以同时靶向免疫细胞上的细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4, CTLA-4)和肿瘤细胞上的程序性死亡配体1(programmed death ligand 1, PD-L1), 提高免疫细胞识别肿瘤细胞的能力, 避免肿瘤细胞发生免疫逃逸, 目前在NSCLC[14]、胰腺导管腺癌[15]等多种癌症领域开展相关研究。
1.1.1.3 联合靶向肿瘤细胞和细胞因子 靶向肿瘤细胞和细胞因子的双特异性抗体不仅能通过与细胞表面的受体/抗原结合阻断肿瘤细胞上的信号传导, 还可以通过与微环境中的细胞因子结合, 阻碍细胞因子与受体结合(图1C)。例如联合靶向肿瘤细胞表面的PD-L1和微环境中的转化生长因子β (transforming growth factor β , TGF-β )的双特异性抗体bintrafusp alfa, 一方面可以避免肿瘤细胞发生免疫逃逸, 而另一方面可以通过阻断TGF-β 信号传导, 恢复患者对抗PD-L1治疗的敏感性, 从而导致肿瘤细胞死亡[16], 目前已在NSCLC[17]、胆道癌[18]、头颈部鳞状细胞癌[19]等多种癌症中验证其治疗作用。
1.1.1.4 联合靶向两种细胞因子 双特异性抗体还可以靶向不同的细胞因子, 降低肿瘤微环境中的细胞因子浓度(图1D), 例如靶向血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)和血管生成素-2(angiopoietin-2, Ang-2)的vanucizumab, 能够显著抑制血管生成作用, 从而抑制肿瘤的生长和转移[20], 用于治疗晚期实体瘤, 包括结直肠癌、乳腺癌、胃癌等多种癌症[21, 22]。
1.1.2 Fc段和Fab段结构
双特异性抗体有多种不同的结构形式(format)[23], 根据是否含有Fc段, 双特异性抗体可以分为:含Fc段的免疫球蛋白G(immunoglobulin G, IgG)型, 这类抗体结构稳定半衰期长, 例如amivantamab[24]等, 对于靶向肿瘤细胞的双特异性抗体, 保留Fc段可促进抗体依赖性细胞介导的细胞毒性(antibody-dependent cell-mediated cytotoxicity, ADCC)/补体依赖性细胞毒性(complement-dependent cytotoxicity, CDC)杀伤肿瘤细胞[25]; 不含Fc段结构的非IgG型, 这类抗体分子量小, 组织渗透性好, 例如CD19-CD3双特异性抗体blinatumomab, 已获批用于治疗费城染色体-阴性、复发性或难治性B细胞-急性淋巴细胞白血病(B cell-acute lymphoblastic leukemia, B-ALL)[26]。
此外, 双特异性抗体可通过一个位于Fab段的抗原结合位点与工程运输载体(engeneic delivery vehicles, EDVs)或其他载荷(payload)结合, 形成独特的负载型, 通过向肿瘤细胞靶向运输细胞毒素、小干扰RNA(small interfering RNA, siRNA)等对肿瘤细胞形成杀伤[23]。例如包含了Fc段的TargomiRs, 用于治疗恶性胸膜间质瘤和肺癌[27], 以及不包含Fc段的DT2219ARL, 用于治疗B细胞恶性肿瘤[28]。
抗体制备平台影响双特异性抗体结构的稳定性, 好的制备平台, 使精细设计的抗体结构成为可能。早期双特异性抗体是通过双杂交瘤细胞法制备而成[29], 然而使用这个方法得到的抗体存在大量轻重链错配, 难以生成稳定的双特异性抗体。迄今为止已经开发了大量技术平台, 诸如Knobs-into-holes[30], CrossMab[31], 双特异性T细胞接合器(bispecific T-cell engager, BiTE)技术[32], 双重亲和力重定向(dual-affinity retargeting, DART)技术[33]等, 大大提高了双特异性抗体的产量和纯度。
Duobody是目前最受青睐的技术平台[34]。Duobody平台是一种基于可控性Fab臂交换(controlled Fab-arm exchange, cFAE)的双特异性抗体技术平台, 具有操作简单、纯度高、稳定性好等优点。
综上, 肿瘤领域优秀的双特异性抗体制备应具备如下特征:精心设计的抗体结构实现独特的疗效机制; 先进的技术平台保障抗体产品的高纯度和结构稳定; 临床试验证实抗体的疗效与安全性。
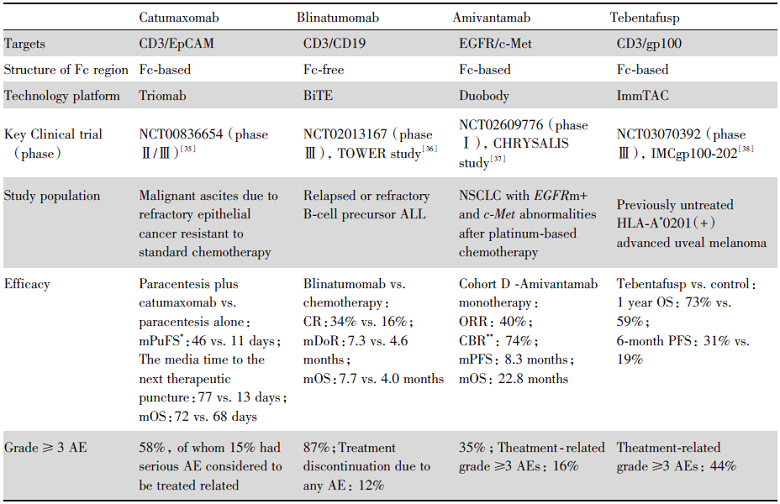
截止2022年4月, 肿瘤领域已经获批上市的双特异性抗体有catumaxomab(2017年退市停产)、blinatumomab、amivantamab和tebentafusp。其中blinatumomab用于治疗血液肿瘤, catumaxomab、amivantamab和tebentafusp用于治疗实体瘤(表1)。
| 表1 四种治疗癌症的双特异性抗体药物特点和临床试验数据 Tab.1 Characteristics and clinical trial data of four bispecific antibodies for the treatment of cancer |
Catumaxomab是最早上市的双特异性抗体, 于2009年经欧洲药品管理局(European Medicines Agency, EMA)批准, 靶向CD3和EpCAM, 通过腹膜内给药途径, 治疗EpCAM阳性的结直肠癌患者的恶性腹水[13], 但由于商业原因于2017年退市停产。病例报告显示, catumaxomab可用于治疗复发性非肌层浸润性膀胱癌[39]。国内外正在开展Ⅰ /Ⅱ 期临床试验(NCT04799847; NCT04819399)对catumaxomab的疗效和安全性作进一步的评估。另一项进行中的Ⅲ 期临床试验(NCT04222114)将评估catumaxomab对晚期胃癌腹膜转移患者的疗效与安全性。
Blinatumomab于2014年12月获美国食品药品监督管理局(Food and Drug Administration, FDA)批准上市, 能同时靶向CD3和CD19, 用于治疗费城染色体-阴性、复发性或难治性B-ALL[36]。
Amivantamab于2021年5月经FDA批准上市, 是靶向EGFR和c-Met的具有完整Fc段的双特异性抗体, 用于治疗携带EGFR外显子20插入突变(exon 20 insertion, Exon20ins)阳性且含铂化疗失败的局部晚期或转移性NSCLC[40]。
Tebentafusp于2022年1月获FDA批准上市, 能同时靶向T细胞上的CD3和黑色素瘤的谱系抗原gp100, 用于不可切除或转移性葡萄膜黑色素瘤, 是首个获批的靶向T细胞受体药物[41]。
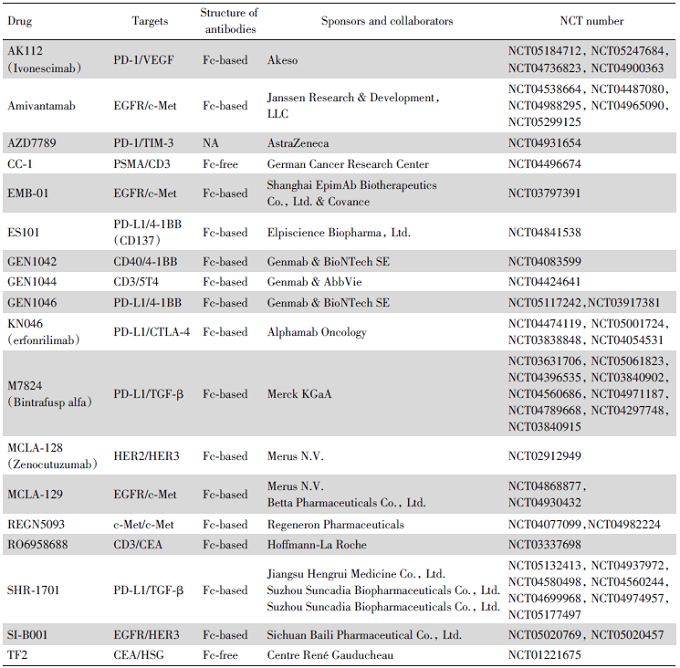
研究数据显示, 中国有超过60%的NSCLC患者存在驱动基因突变阳性[42], 双特异性抗体有望提高这部分患者的疗效。截止2022年4月5日, 以双特异性抗体(bispecific antibody)、干预性试验(interventional studies)以及肺癌(lung cancer)在美国临床试验注册中心(https://clinicaltrials.gov/)进行检索, 共有40项Ⅱ ~Ⅲ 期临床试验与NSCLC相关(表2)。除amivantamab已获批上市外, 其他双特异性抗体均在研发中。
| 表2 18种双特异性抗体在非小细胞肺癌中的研究 Tab.2 Studies of 18 bispecific antibodies in non-small cell lung cancer |
Amivantamab是靶向EGFR和c-Met的双特异性抗体, 对携带EGFR Exon20ins的NSCLC患者具有良好的疗效[37], 是首个获批的NSCLCEGFR Exon20ins治疗药物[43]。据估计约10%~12%的EGFR突变为EGFR Exon20ins, 占总体NSCLC患者的2%~3%, 这部分患者对目前的EGFR-TKI均不敏感[44, 45]。Amivantamab的出现解决了这部分患者未满足的临床治疗需求。
目前amivantamab已被美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)发布的NSCLC临床实践指南推荐为携带EGFR Exon20ins突变且经过初始系统治疗进展的NSCLC患者后线治疗选择[46]。从2021年开始中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)NSCLC诊疗指南也已将amivantamab纳入Ⅳ 期EGFR Exon20ins突变NSCLC患者的后线治疗推荐[47]。Amivantamab也已进入国家药品监督管理局药品审评中心突破性治疗药物审批程序。
肺癌领域绝大多数针对驱动基因突变的靶向药物能抑制的突变类型有限, 容易发生原发性或继发性耐药[48]。有研究显示, 大多数携带EGFR突变的NSCLC患者, 在接受EGFR-TKI治疗后的9~19个月内即会产生耐药性[49, 50]。双特异性抗体的出现改善了驱动基因阳性NSCLC患者的疗效。研究表明, amivantamab不仅在携带EGFR Exon20ins突变的NSCLC患者中安全有效, 对其他类型EGFR突变(例如外显子19del突变、L858R突变、T790M突变、C797S突变等)和MET扩增导致的继发性耐药的患者也具有明显疗效, 为第三代TKI耐药患者带来了新希望[51, 52, 53]。
3.1.1 Amivantamab的结构
Amivantamab是使用Duobody cFAE平台制备的IgG1型双特异性抗体, 有两个分别靶向EGFR和c-Met的单价结合臂, 使用单价臂能够有效避免受体的二聚化所导致的信号通路激活[24]。糖基化修饰后的Fc段具有免疫细胞导向活性。在用于制备双特异性抗体的亲本抗体中, c-Met单克隆抗体的405位苯丙氨酸被亮氨酸所替代(F405L), 而EGFR单克隆抗体的409位精氨酸被赖氨酸所替代(K409R)[24]。
3.1.2 Amivantamab的作用机制
EGFR基因突变导致受体下游通路异常激活, 是NSCLC发生的驱动因素之一[54]。c-Met与EGFR一样, 同属于受体酪氨酸激酶, 其异常激活或扩增不仅参与肿瘤细胞增殖、存活、转移及血管生成, 还可以作为EGFR的替代途径, 激活下游蛋白激酶B(protein kinase B, PKB/Akt)信号传导, 参与EGFR-TKI耐药的发生[9, 49, 55]。
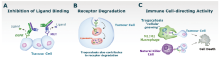
Amivantamab主要通过三条途径发挥其抗肿瘤作用(见图2)[56]。
3.1.2.1 抑制配体结合 Amivantamab对EGFR和c-Met具有较高的亲和力, 与其结合后可剂量依赖性阻碍它们与相应配体[表皮生长因子(epidermal growth factor, EGF)和肝细胞生长因子(hepatocyte growth factor, HGF)]的结合(图2A), 显著抑制EGFR和c-Met的激活, 继而抑制其下游通路的异常激活, 例如细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)和Akt的磷酸化。研究显示, amivantamab能够比EGFR或c-Met单特异性抗体更有效地抑制ERK和Akt的磷酸化[9]。
3.1.2.2 促进受体降解 Amivantamab与EGFR和c-Met受体结合后, 不仅能抑制EGFR/c-Met受体活性, 还可促进受体的内吞降解, 导致受体失活(图2B), 进而抑制原发性/继发性EGFR突变和c-Met突变的下游通路异常激活[9]。
3.1.2.3 免疫细胞导向活性 Amivantamab的Fc段与免疫细胞结合, 增强肿瘤杀伤作用(图2C)。抗体Fc段可与自然杀伤(natural killer, NK)细胞结合, 介导经典的ADCC反应, 触发NK细胞释放细胞因子、穿孔素、颗粒酶等细胞溶解酶颗粒, 最终杀死靶细胞, 是清除肿瘤细胞的关键作用机制[57]。Fc结构与Fcγ R的结合还会诱导抗体依赖的细胞因子分泌(antibody-dependent cytokine release, ADCR), 募集巨噬细胞和单核细胞等先天免疫细胞[48]。
Amivantamab的Fc段还可与免疫细胞如巨噬细胞上Fcγ R结合(图2C), 诱导抗体依赖性细胞吞噬作用(antibody-dependent cellular phagocytosis, ADCP)和胞啃作用(trogocytosis), 参与消除肿瘤细胞[48]。胞啃作用是将供体细胞(即肿瘤细胞)的表面分子转移到受体细胞(即免疫细胞)上的过程, 目前已发现存在于多种免疫细胞, 在抗原呈递的过程中发挥重要作用[58]。同时胞啃作用还能下调肿瘤细胞的EGFR和c-Met水平, 促进肿瘤细胞的凋亡[48]。
3.1.3 Amivantamab的临床研究进展
CHRYSALIS(NCT02609776)是一项首次人体、开放标签、多中心的Ⅰ 期剂量递增和剂量扩展试验, 用以评估amivantamab单药及其联合lazertinib(第三代EGFR-TKI)用药在治疗成人NSCLC中的安全性、药代动力学和初步疗效。在第一部分剂量递增阶段, 确定amivantamab单药、amivantamab联合lazertinib和amivantamab联合化疗(卡铂和培美曲塞)的2期推荐剂量。在第二部分剂量扩展阶段, 纳入含铂化疗进展的患者, 根据EGFR和MET突变状态和既往治疗情况, 分为以下9个队列:EGFR依赖的耐药队列(cohort A)、非EGFR依赖的耐药队列(cohort B)、三代EGFR-TKI治疗后合并EGFR C797S突变队列(cohort C)、EGFR Exon20ins队列(cohort D)、amivantamab联合lazertinib治疗EGFR常见突变队列(corhort E)队列、EGFR-TKI治疗后合并MET扩增队列(cohort MET-1)和MET外显子14跳跃队列(cohort MET-2)、NSCLC腺癌合并EGFR野生型过表达队列(cohort WT-Ad)、NSCLC鳞癌合并EGFR野生型过表达队列(cohort WT-Sq)[37]。
2020年5月18日《J Clin Oncol》杂志公布了CHRYSALIS研究EGFR Exon20ins队列(cohort D)的初步结果[53]; 随后世界肺癌大会(World Conference of Lung Cancer, WCLC)2020大会更新了研究结果[37], 对接受2期推荐剂量amivantamab治疗的EGFR Exon20ins NSCLC患者进行了安全性和疗效分析。盲法独立中心审查(blinded independent central review, BICR)评估的ORR为40%[95%可信区间(confidence interval, CI)29~51], 中位DOR为11.1个月(95%CI 6.9~未达到), CBR(部分和完全缓解+疾病稳定≥ 11周)为74%(95%CI 63~83), 中位PFS为8.3个月(95%CI 6.5~10.9), 中位OS达到22.8个月(95%CI 14.6~未达到)[37]。安全性分析显示:AE发生率为99%, 3级及以上AE发生率为35%, 3级及以上治疗相关AE发生率为16%, 10%的患者因AE终止了治疗, AE相关死亡发生率为7%, 常见的治疗相关AE包括皮疹(86%)、输液相关反应(infusion-related reaction, IRR)(66%)和甲沟炎(45%)。IRR几乎只发生在第一次给药的时候, 很少在后续给药中复发, 对后续治疗影响甚微。基于CHRYSALIS研究结果, amivantamab经FDA加速审批于2021年5月上市, 为EGFRExon20ins突变的NSCLC患者提供了敏感的靶向药物。
为了进一步提高amivantamab对NSCLC的治疗效果, 扩大治疗人群, 目前有多项临床试验正在对amivantamab联合用药潜力进行探索。开放标签的Ⅲ 期对照试验PAPILLON研究(NCT04538664), 评估amivantamab联合铂类化疗相较于化疗用于一线治疗携带EGFR Exon20ins突变的局部晚期或转移性NSCLC患者的疗效和安全性。另一项Ⅲ 期试验MARIPOSA研究(NCT04487080), 将在携带EGFR突变(外显子19del突变或外显子21 L858R突变)的局部晚期或转移性NSCLC患者的一线治疗中比较amivantamab+lazertinib联合方案与奥希替尼单药治疗的疗效和安全性。开放标签的MARIPOSA-2 Ⅲ 期试验(NCT04988295)同样纳入携带EGFR突变(外显子19del突变或外显子21 L858R突变)的局部晚期或转移性NSCLC患者, 比较奥希替尼治疗失败后采用amivantamab+lazertinib+卡铂+培美曲塞的联合治疗和卡铂+培美曲塞化疗的疗效和安全性。
ClinicalTrial上检索到, 在NSCLC治疗领域共有18个在研的双特异性抗体, 开展了46项Ⅱ ~Ⅲ 期临床试验(见表2)。其中靶点含免疫检查点PD-1/PD-L1/CTLA-4的双特异性抗体7个, 靶点含EGFR突变的双特异性抗体4个, 目前双特异性抗体靶点组合的主要策略是一个有获批肺癌药物的靶点联合一个无获批肺癌药物的靶点。在研的Ⅲ 期临床试验中, 有3项amivantamab临床试验(NCT04538664, NCT04487080, NCT04988295), KN046(NCT05001724, NCT04474119)有2项临床试验, Bintrafusp Alfa、AK112、SHR-1701和SI-B001各有1项临床试验(分别为NCT03631706, NCT05184712, NCT05132413, NCT05020769)。
EGFR-TKI治疗后再进展的患者是广受关注的人群。随机、双盲、多中心Ⅲ 期临床研究(NCT05184712)将在EGFR-TKI治疗失败的EGFR突变局部晚期或转移性非鳞状NSCLC患者中, 比较培美曲塞和卡铂治疗联合AK112(靶向PD-1/VEGF)或培美曲塞和卡铂联合安慰剂的疗效和安全性。随机双盲、多中心Ⅲ 期临床研究(NCT05132413)也将纳入EGFR-TKI治疗失败的EGFR突变晚期或转移性非鳞状NSCLC患者, 评估比较SHR-1701(靶向PD-L1/TGF-β )联合贝伐珠单抗和化疗的疗效和安全性。Ⅱ /Ⅲ 期开放标签临床试验(NCT05020769)预计纳入局部晚期或复发性NSCLC患者, 患者在既往EGFR-TKI治疗中出现疾病进展、无TKI致敏突变或携带EGFR Exon20ins突变, 该试验旨在评估SI-B001(靶向PD-L1/TGF-β )联合奥希替尼在不同患者中的疗效和安全性。
KN046和bintrafusp alfa的Ⅲ 期临床试验均在无驱动基因突变的NSCLC患者中进行。Ⅱ /Ⅲ 期临床试验(NCT05001724)将评估KN046(靶向PD-1/CTLA-4)联合仑伐替尼在含铂双药化疗联合免疫治疗失败患者中的疗效与安全性。另一项Ⅲ 期临床试验(NCT04474119)评估KN046联合卡铂和紫杉醇用于Ⅳ 期肺鳞癌患者一线治疗的疗效与安全性。Ⅲ 期临床研究(NCT03631706)纳入PD-L1高表达的晚期初治NSCLC患者, 评估bintrafusp alfa(靶向PD-L1/TGF-β )联合帕博利珠单抗的疗效和安全性。
双特异性抗体在肺癌领域已成为药物研发的热点, 其在携带和未携带驱动基因突变的肺癌患者中的疗效与安全性值得不断探索。双抗良好的耐受性使联合治疗成为研发的重点方向, 联合靶向药物和/或化疗策略具备很强的治疗潜力。
早在1961年发明了首个靶向不同抗原的双特异性抗体[59], 但受限于生产技术, 直到1990年才启动首个双特异性抗体临床试验[60]。双特异性抗体靶点组合策略和生产技术仍处于发展阶段, 影响双特异性抗体临床疗效和安全性的因素有待于进一步探索。
在抗体的结构设计上, BiTE等非IgG的双特异性抗体因为不包含Fc段, 所以分子量小, 易于被清除, 半衰期短; 而IgG结构的双特异性抗体虽然分子量大, 半衰期长, 但组织渗透性较差, 用于实体瘤时可能影响疗效[61]; Fc段还可能导致潜在的细胞毒性从而造成器官损伤等[62]。双特异性抗体目前所面临的巨大挑战是根据靶点和疾病选择或设计合适的抗体构型, 在保持抗肿瘤效果同时尽量降低抗体相关毒性。而在生产技术平台上, 如何有效解决双特异性抗体轻重链错配的问题, 一直是过去几十年双特异性抗体开发过程中难以回避的技术难题[63]。
传统的动物模型通过转基因技术、化学诱导等方法建立肺癌模型[64], 无法反映人类癌症发生的固有遗传因素和细胞复杂性[65], 靶点结合特性与人类相比也存在种属差异, 难以在临床前阶段准确评估药物的靶点、药理及毒理。目前常用的临床前评价模型除了人源化动物模型[66]和MABEL模型[67]外, 还包括离体的细胞3D共培养以及在体的肿瘤异种移植模型[68], 例如可用于研究毒理学、肿瘤微环境的精密切割肺片(precision-cut lung slices, PCLS)[65]和类器官(organoid)[69, 70, 71, 72]等。因此在临床前研究中可以考虑选择其他更能反映机体实际情况的临床前评估模型。
对既往靶向药物不敏感的驱动基因突变, 例如EGFR Exon20ins, 在以往临床实践中往往面临着“ 有靶无药” 的状况, 严重影响了患者预后。双特异性抗体近十年来发展迅速, 为治疗NSCLC提供了新的治疗思路。Amivantamab作为同时靶向EGFR和c-Met的双特异性抗体, 在临床试验中证实了双特异性抗体在肺癌领域的治疗价值。作为单药, amivantamab具有良好的疗效和安全性, 在临床治疗中表现不俗。Amivantamab还可以联合其他药物, 为患者提供更加灵活的治疗策略, 满足患者的治疗需求。
靶点组合的多样性是克服耐药性的策略之一[7, 25]。三代TKI耐药患者缺乏有效的后线治疗, 而amivantamab在这些患者中的疗效提示了双特异性抗体在继发性耐药患者中的临床价值。除了目前经典的EGFR、c-Met、PD-1、CD3等靶点外, 还可以通过与其他一些潜在靶点比如CD47[73]、CD147[74]等进行组合, 甚至有可能发挥出不同靶点间的协同效应[75, 76], 提高抗肿瘤活性。
除了常规的静脉输注给药, 目前还在探索其他新型抗体给药方式, 包括透皮给药、口腔/鼻腔给药、口服给药等[77], 比如amivantamab目前正有一项通过皮下给药治疗晚期实体恶性肿瘤的POLOMA研究(NCT04606381)[78]。这些非侵入性给药方式为患者带来极大的便利, 有利于提高患者的依从性[79]。对于肺癌患者来说, 肺部给药是一种值得考虑的新型给药方式[80]。
随着靶点组合策略的多样化, 技术平台的发展, 抗体结构的多态化以及给药方式的新尝试, 双特异性抗体将为肺癌领域药物联合治疗带来新希望。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|