| 李秋,教授、医学博士、主任医师、博士生导师,四川大学华西医院肿瘤内科副主任,四川省学术和技术带头人。兼任中国医师协会肝癌专业委员会内科专业委员会主任委员、中国抗癌协会肿瘤支持治疗内科专业委员会副主任委员、中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)中西医结合专家委员会常务委员、中国生物医学工程学会肿瘤分子靶向治疗专业委员会常务委员、四川省抗癌协会第一届抗癌药物专业委员会主任委员、四川省国际医学交流促进会第一届消化道肿瘤专业委员会主任委员、成都市医学会第一届药物经济学专业委员会主任委员等。 |
Wang F, Huang YS, Wu HX, et al. Genomic temporal heterogeneity of circulating tumour DNA in unresectable metastatic colorectal cancer under first-line treatment[J]. Gut, 2022, 71(7):1340-1349.
1b。
目前二代测序(next generation sequencing, NGS)已广泛应用于转移性结直肠癌(metastatic colorectal cancer, mCRC)系统治疗药物选择, 但在疗效及预后预测方面仍有较大的未被满足的临床需求。
本研究是一项前瞻观察性研究, 纳入初治的mCRC患者, 连续监测在一线治疗期间循环肿瘤DNA(circulating tumor DNA, ctDNA)中体细胞变异变化, 以探索ctDNA中基因突变的水平与临床结局的潜在相关性。
• 研究条件:中国中山大学肿瘤防治中心开展的研究(NCT04228614)。
• 研究时间:2018年4月12日至2020年1月16日。
• 研究方法:单中心、前瞻性研究。
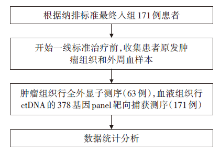
• 研究对象:不可切除的mCRC, 主要入组标准包括:(1)经组织病理学或细胞学诊断为mCRC; (2)采集基线样本前从未接受过一线治疗; (3)有合格的基线样本和后续血浆样本(至少产生20 ng DNA), 或只有基线血浆样本及原发性肿瘤组织(至少产生50 ng DNA)的患者。主要排除标准为一线治疗期间接受根治性切除或消融转移灶且未获得疾病证据的患者。研究流程简图见图1。
• 评价指标:ctDNA, 单核苷酸变异(single-nucleotide variant, SNV), 拷贝数变异(copy number variation, CNV), 无进展生存期(progression-free survival, PFS), 总生存期(overall survival, OS)。
• 验证ctDNA作为实时监测肿瘤基因突变材料的可靠性:63例配对基线组织和血浆样本中的RAS/BRAF突变为51/63(81.0%)。
• 一线治疗中ctDNA基因组显示时间异质性:(中位治疗时间=4.67m)在临床标准治疗靶点中, 42.6%(26/61)基线RAS突变的患者在治疗过程中突变清除; 50%(5/10)BRAF突变患者突变被清除; 相反, 3.6%(3/84)和0.7%(1/135)的患者的ctDNA结果分别显示了新的RAS突变及BRAF突变。此外, 1例患者发生了ERBB2扩增的清除。而在临床试验相关靶点, KRAS G12C、BRAF nonV600E、PTEN、NF1、MTOR、CDK12、CDKN2A、FGFR1/2/3等突变的状态改变一共仅发生在12.4%(18/145)的患者中大多数无明显变化。
• ctDNA中RAS与BRAF V600E的变化反映预后:当血浆中RAS/BRAF基因由突变型转变为野生型时, 表明患者疗效较好且预后较好, 而出现RAS/BRAF突变预示着不良的结局。
这项前瞻性血液ctDNA分析揭示了mCRC体细胞突变的时间异质性, 在这过程中血浆RAS/BRAF突变状态改变可能影响mCRC患者预后。
晚期结直肠癌患者因分子异质性会对治疗产生原发或继发耐药。目前临床上监测疗效的方法主要包括定期影像学检查和癌胚抗原(carcinoembryonic antigen, CEA)水平监测, 但影像学检查无法检测微小病灶; CEA水平并不总是跟肿瘤负荷完全一致[1]。因此, 对于迫切需要更可靠的生物标志物辅助制定个性化的治疗策略。前期研究发现ctDNA检测具有便捷、敏感等优势[2]。该研究通过动态监测mCRC患者一线治疗前后ctDNA中体细胞突变的演变, 揭示了晚期结直肠癌基因动态变化对治疗、预后的影响。
该研究采用了超高深度的NGS测序, 满足了晚期肿瘤的液体活检的要求, 表明通过血液中ctDNA监测基因突变的可靠性, 与肿瘤组织检测结果具有较高的一致性(81%)。通过检测ctDNA中基因突变的变化发现, 发生RAS或BRAF清除的患者和起初且保持RAS或BRAF持续野生型的患者的临床预后是相似的[RAS-mPFS:12.8m vs. 13.2m, mOS; 未达到(not reached, NR)vs. 31.4m; BRAF-mPFS:NR vs. 11.5m, mOS:NR vs. 26.7m], 且显著高于RAS(mPFS:7.9m, P=0.002; mOS:14.5m, P=0.006)或BRAF(mPFS:6.4m, P=0.002; mOS:11.4m, P=0.022)保持突变的患者。相反, 新出现RAS(mPFS:7.9m, P=0.002; mOS:6.1m)或BRAF(mPFS:8.7m)突变的患者和起初伴有RAS或BRAF突变的患者预后无明显差异, 但均比始终无RAS或BRAF突变的患者差。因此治疗相关基因突变的变化对mCRC患者预后影响更大。
ctDNA检测基因突变、评估微小残留肿瘤(minimal residual disease, MRD)等内容用于肿瘤疗效预测已有一定的研究进展。CALGB/SWOG-80405研究中[3]的治疗前和进展后的配对血浆进行ctDNA检测后发现获得性基因组突变(RAS、BRAF和EGFR-胞外域突变; ERBB2和MET扩增)在一线使用西妥昔单抗(6.6%)或贝伐珠单抗(10.1%)患者进展后的比例均较低, 而在后线使用抗EGFR治疗进展患者中高达62%, 因此检测ctDNA获得性基因组突变有潜在价值可指导抗EGFR再挑战治疗的时机。在Ⅱ 期CHRONOS研究[4]中, 研究者们检测了RAS野生型mCRC患者接受以抗EGFR为基础的治疗方案前后的ctDNA中RAS/BRAF/EGFR突变水平, 发现在27例检测到突变的患者后线接受帕尼单抗后, 30%的患者(8例)实现了部分缓解, 63%的患者(17例)肿瘤得到了控制, 有效率高于标准三线治疗, 表明ctDNA可及时有效、安全地指导mCRC患者后线抗EGFR再挑战。PLATFORM-B研究发现ctDNA中RAS/BRAF突变负荷减少与更长的PFS密切相关[风险比(hazard ratio, HR)=0.23, P=0.001], 也说明了RAS/BRAF突变是CRC的不良预后因素[5]。但包括上述研究在内的多数ctDNA相关研究均未与组织检测基因突变水平进行配对对比。
虽然目前已有多项研究表明ctDNA在CRC中的应用潜力, 但大多为小样本研究, 且多数仅检测基线水平, 其预测的敏感性和特异性十分有限。该研究通过动态监测mCRC患者血液ctDNA中体细胞突变的变化来观察疗效和预后, 且进行了组织和血液配对检测, 更有说服力、更有应用价值和实际意义, 我们需要思考以下问题:
第一, 该研究仅为单中心结果, 期待能在更大样本量和更多国家和地区的患者中得到验证。
第二, 血液中ctDNA检测体细胞突变的不稳定性和不确定性是目前应用的最大障碍。该研究ctDNA检测与肿瘤组织的匹配度仍有待进一步提高, 需要进一步验证敏感性和精准度, 形成标本取样和检测方法的统一标准, 以更好的指导临床应用。
第三, 基因突变“ 清除” 的概念需要进一步明确。血液中肿瘤的基因突变丰度低于多少是“ 清除” , 是低于晚期肿瘤液体活检的检测限算“ 清除” , 还是低于CRC MRD的检测限算“ 清除” ?同时, 对于NGS液体活检结果的解读也更要谨慎, 特别是阴性结果, 是肿瘤DNA没有突变, 还是采取的血液样本中, 没有肿瘤DNA?如果能够结合基因的甲基化特征, 确定血液样本中存在结直肠癌DNA, 则对我们理解肿瘤基因的“ 清除” 更有帮助。
路漫漫其修远兮, 将ctDNA真正应用于mCRC在内的实体瘤中个体化治疗仍有很长的一段路要走, 相信随着分子和基因检测方法日益精准, ctDNA在mCRC的临床应用值得我们期待。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|