| 陈功,教授、主任医师、博士研究生导师,中山大学肿瘤防治中心结直肠科副主任。学术兼职包括中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)副秘书长、常务理事,亚洲临床肿瘤学联盟(Federation of Asian Clinical Oncology,FACO)副秘书长,2015-2017年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)学术委员会委员,广东省抗癌协会大肠癌专业委员会主任委员,2019年第三届“国之名医·优秀风范”获得者,CSCO结直肠癌专家委员会副主任委员、秘书长,CSCO结直肠癌指南专家组秘书、执笔人,中国医师协会结直肠外科医师分会常务委员,中国抗癌协会大肠癌专业委员会委员,中国医师协会结直肠肿瘤专业委员会肝转移分会副主任委员,欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)会员。 |
Tie, J, Cohen, JD, Lahouel, K, et al. Circulating tumor DNA analysis guiding adjuvant therapy in stage Ⅱ colon cancer[J]. N Engl J Med, 2022, 386(24):2261-2272.
1b。
辅助化疗对Ⅱ 期结肠癌的作用仍有争议。手术后存在循环肿瘤DNA(circulating tumor DNA, ctDNA)预示着无复发生存率很低, 而不存在ctDNA则预示着复发风险低。对ctDNA阳性患者采取辅助化疗的获益尚未明确。
比较对于Ⅱ 期结肠癌患者评估ctDNA指导的治疗方法可否减少辅助化疗的使用, 同时不增加复发风险。
• 研究条件:在23个澳大利亚研究中心, 共计纳入459例患者(DYNAMIC澳大利亚新西兰临床试验注册号ACTRN12615000381583)。
• 研究方法:本试验是一项生物标志物驱动辅助治疗的Ⅱ 期、多中心、随机、对照试验。
• 研究时间:2015年8月10日至2019年8月2日。
• 研究对象:接受切除术后经组织学证实的切缘为阴性的Ⅱ 期(T3或T4, N0, M0)结肠或直肠腺癌患者。符合纳入条件的患者的美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态评分为0~2分(评分范围为0~5分, 评分较高表示失能较严重), 脏器功能必须能够承受基于奥沙利铂或单药氟尿嘧啶的辅助化疗。纳入前8周内进行的胸部、腹部和盆部计算机断层扫描(computed tomography, CT)发现有肉眼可见的转移性疾病证据的患者被排除。其他排除标准包括筛选之前3年内有另外一种原发癌的病史、存在同时性原发结肠直肠癌或者接受过新辅助放化疗。患者在术后3周内被纳入, 截至术后4周, 从切除的肿瘤获得了足够的样本进行突变分析。
• 干预措施:以2∶ 1的比例将患者随机分组, 两组患者分别根据ctDNA结果接受治疗(ctDNA指导的治疗), 或者由经治医师根据标准的临床病理指标制定治疗方案(标准治疗)。本试验利用区组随机化将各患者分配至试验组, 并根据参与中心的地点(地区或大都市)和肿瘤分期(T3或T4)分层。在术后第4周和第7周, 从全部患者获得血浆样本进行ctDNA分析。在通过集中病理学评估确认有足够的肿瘤组织并确认有足够的第4周血液样本后, 患者接受了随机分组。对于被分配接受ctDNA指导的治疗的患者, 第4周和第7周的样本同时进行分析, 在术后8~10周, 经治临床医师可获知ctDNA结果。第4周或第7周ctDNA结果为阳性的患者接受氟尿嘧啶单药或基于奥沙利铂的辅助化疗, 治疗方案由临床医师选择。第4周和第7周ctDNA结果均为阴性的患者未接受辅助化疗。
• 评价指标:主要终点为2年无复发生存率。次要终点包括ctDNA指导组ctDNA阳性和ctDNA阴性患者的无复发生存率、至复发的时间和总生存期。探索性终点包括接受辅助化疗的ctDNA阳性的患者中的ctDNA清除率、患者害怕复发的程度和成本效益。该文未报告总生存期数据和探索性终点的结局。
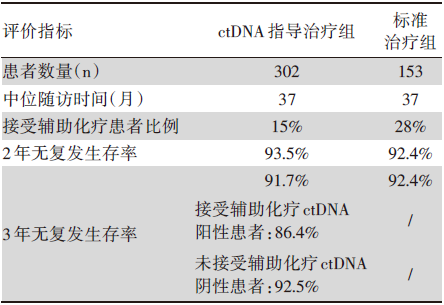
在接受随机分组的455例患者中, 302例被分配至ctDNA指导的治疗组, 153例被分配至标准治疗组。中位随访期为37个月。ctDNA指导组接受辅助化疗的患者比例低于标准治疗组[15% vs. 28%; 相对危险度, 1.82; 95%可信区间(confidence interval, CI)1.25~2.65]。在2年无复发生存率的评估中, ctDNA指导的治疗不劣于标准治疗[(分别为93.5%和92.4%; 绝对差, 1.1个百分点; 95%CI -4.1~6.2(非劣效性界值, -8.5个百分点)]。3年无复发生存率如下:接受辅助化疗的ctDNA阳性患者为86.4%, 而未接受辅助化疗的ctDNA阴性患者为92.5%, 见表1。
| 表1 DYNAMICⅡ 研究主要结果 |
ctDNA指导的Ⅱ 期结肠癌治疗减少了辅助化疗的使用, 同时未降低无复发生存率。
结直肠癌是全球第三高发[1]、中国第二高发[2]癌症, 目前针对非转移性结肠癌的标准治疗方式仍以手术治疗联合或不联合辅助化疗为主, 术后的5年生存率也不尽相同, 与患者的临床病理分期相关, 分期较早的患者仅需手术治疗, Ⅰ 期患者5年生存率可达90%, 而Ⅱ ~Ⅲ 期患者, 单纯根治术后的5年生存率则分别降至80%及60%左右, 而20%~40%的患者会出现术后复发转移[1]。
结直肠癌根治术后的辅助化疗是减少复发转移、改善生存的重要治疗策略, 1990年代起氟尿嘧啶单药、2004年以后氟尿嘧啶联合奥沙利铂的联合方案成为Ⅱ /Ⅲ 期结肠癌术后的标准辅助化疗方案, 总体而言, 能给Ⅱ 期患者带来大约5%的生存获益, Ⅲ 期患者获益大约15%左右[3, 4]。目前国际国内指南对结直肠癌术后辅助化疗的标准推荐为:Ⅰ 期肠癌无需辅助化疗; Ⅱ 期结肠癌根据临床病理因素分为:低危[错配修复缺陷(mismatch repair-deficient, dMMR)者]无需化疗, 普危[错配修复完整(mismatch repair-proficient, pMMR)且无高危因素]可以考虑氟尿嘧啶单药化疗, 高危(pMMR且合并高危因素)推荐联合方案化疗3个月; 基于IDEA研究结果[5], Ⅲ 期结肠癌根据危险度分层推荐联合方案化疗3个月(低危患者, T1-3N1)或6个月(高危患者, T4或N2)。
结直肠癌术后辅助化疗目前的标准决策因素是病理分期及其相关的临床病理参数, 上述数据显示无论Ⅲ 期还是Ⅱ 期患者辅助化疗的获益均有限, 而且目前的传统辅助化疗模式无法更精准筛选治疗获益人群, 需要将同一临床病理分期特征的大量群体全部进行治疗, 而真正生存获益的仅是其中一部分人群, Ⅱ 期尤为明显。提示单纯临床病理参数已经难以精准筛选辅助化疗获益人群, 如何避免过度治疗、平衡疗效与毒副作用, 更精准的标志物开发便成为迫切需求; 微小残留病灶(minimal residual disease, MRD)成为近年来该领域最热门也是最有希望的标志物。
MRD意指根治性治疗(如手术)后现有常规临床及影像学手段无法检测到的肿瘤残留病灶/细胞, 可能是疾病复发转移的最重要原因之一。根治术后如果MRD阴性, 提示体内肿瘤已经完全被“ 清零” , 复发风险极低, 也就无需辅助化疗; 如果术后MRD仍然阳性, 提示体内仍有活性癌细胞存在, 复发风险极高, 而术后辅助化疗可能清除体内MRD, 以达到延缓或阻止肿瘤复发转移的目的, 进而提高生存率。
因此, 精准医学时代, MRD在实体瘤术后个性化辅助治疗决策中被寄予厚望:在传统决策基础上, 基于MRD状态来实施个性化“ 加减法” 治疗策略, MRD阴性者, 在传统治疗基础上做“ 减法治疗” , 包括部分人群豁免化疗、减少化疗药物强度、缩短化疗周期等; 反之, MRD阳性者则进行“ 加法治疗” , 包括传统低危无需化疗群体给予化疗、增加化疗药物强度、延长化疗周期等; 在此大背景下, 如何准确检测肠癌术后MRD、又能否基于MRD状态来指导个性化辅助治疗决策是当前业界的热点话题。
ctDNA液体活检是检测MRD最常用的技术, 其拥有无创、简便且能够保留大部分肿瘤特征性遗传物质等诸多优点。众多研究表明, 基于ctDNA的检测可用于判断MRD状态, 成为潜在的复发风险预测和术后疾病动态监测的新技术, 已经被认为是MRD的可靠标志物[6]。目前, 常用的ctDNA检测技术主要包括微滴式数字PCR(droplet digital PCR, ddPCR)与二代测序(next generation sequencing, NGS)。
早期研究更多基于ddPCR的ctDNA检测方法开展, 其敏感度高, 检测下限可达0.05%, 但只能检测单个或少量已知突变。2019年IDEA-FRANCE是该类技术的代表性研究[7], 通过检测血浆中2个甲基化产物回顾性评估Ⅲ 期结肠癌术后MRD的预后价值, 发现术后ctDNA阳性率为13.8%; ctDNA状态与预后明显相关, 阴性者2年无病生存率高达82%, 而阳性者则降至64%; 而且, ctDNA阳性者如果只接受3个月辅助化疗则预后最差。展示了ctDNA在结肠癌中优秀的预后预测价值与指导个性化辅助治疗的潜力。
NGS作为一种高通量测序手段, 用于ctDNA检测已受到国内外专家认可并推荐。其技术路线基于是否需要对肿瘤组织样本检测分析分为两大类:肿瘤未知分析(tumor-agnostic/naive assays)策略和肿瘤先验分析(tumor-informed assays)策略。
Tumor-agnostic策略无需肿瘤样本, 基于固定panel进行血液ctDNA检测。该种方法的优点在于技术成熟、成本低廉、可检测多原发肿瘤, 但该种方法缺点则是针对单一癌种检测灵敏度较差, 例如其代表产品Guardant Reveal尽管联合了甲基化检测, Ⅳ 期结肠癌的术前阳性率仅为66.7%[8]。为进一步提高检测灵敏度, 除结合甲基化外, 对血液及肿瘤组织同时进行NGS检测, 通过生信分析生成更具有特异性的固定化panel的策略也被采用。笔者团队参与完成的研究即利用由肿瘤NGS测序得出的425个基因组成的固定panel对240例Ⅱ ~Ⅲ 期结肠癌患者肿瘤组织及术前血、术后3~7天血、随访监控血进行检测, 并表明术后ctDNA持续阳性复发风险比阴性患者高出32倍, 进一步为临床ctDNA应用增添了证据, 但由于技术流派本身特点, 术前血阳性率也仅为64.2%, 术后7天阳性率8.63%[9]。
相较于前述策略, tumor-informed策略具有更高的灵敏度。该技术可通过对同一患者的白细胞测序来排除非肿瘤来源的突变以设计出高度定制化的panel, 同时测序深度可达100 000× , 这极大的提高了ctDNA-MRD检测的灵敏度。以Signatera方案为基础的Circulate Japan研究[10]是此类策略的经典研究, 其Ⅳ 期肠癌(接受过新辅助化疗)术前阳性率可达84%, 而Ⅱ ~Ⅲ 期术前阳性率可达95%, 其中Ⅱ 期患者术后1个月阳性率7.76%, Ⅲ 期则为22.9%。2020年以后笔者团队也和燃石公司合作, 使用tumor-informed技术的brPROPHET panel在117例Ⅰ ~Ⅳ 期肠癌中检测MRD, 数据表现亮眼, Ⅱ 期和Ⅲ 期患者术前阳性率均为98%, 术后1个月ctDNA阳性率Ⅱ 期为6.97%, Ⅲ 期为21.9%, 该结果也被2023年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)胃肠道(gastrointestinal, GI)会议接受为壁报展示(ASCO GI 2023, 摘要号213)。Safe-SeqS是tumor-informed策略的另一代表性方案, 该方案对组织样本进行结肠癌相关15基因的小panel检测, 对拥有2个以上变异的panel进行ctDNA-MRD检测, 本文评价主体DYNAMICⅡ 研究便是其代表性研究之一[11, 12]。
DYNAMIC Ⅱ 研究主要探索了结肠癌Ⅱ 期患者基于ctDNA-MRD检测能否优于现有辅助治疗策略的实际问题, 研究结果表明, ctDNA指导治疗组可使约一半的患者(从28%减少至15%)免予辅助化疗且2年无复发生存率不受损, 分别为93.5%和92.4%(95%CI, -4.1%~6.2%), 而亚组分析结果显示在ctDNA指导治疗组联合奥沙利铂的比例高于标准治疗组, 分别为62%与10%, 提示对于MRD阳性患者, 临床实际更倾向于使用以奥沙利铂为基础的联合化疗模式。ctDNA指导治疗组中MRD阳性患者以奥沙利铂为基础的联合化疗3年无复发生存率优于单药氟尿嘧啶化疗, 分别为92.6%和76.0%, 可预见MRD阳性患者需强化治疗的趋势。
DYNAMIC Ⅱ 研究作为第一项基于ctDNA-MRD指导Ⅱ 期结肠癌患者术后辅助治疗的前瞻性干预性随机对照试验, 十分具有预见性, 完美的诠释了基于MRD状态的个性化辅助化疗“ 加减法策略” , 为Ⅱ 期结肠癌患者的术后辅助治疗决策提供了直接依据, 也真正吹响了MRD指导辅助治疗决策的号角, 意义重大, 影响深远, 相信这也是该研究能发在《N Eng J Med》的主要原因。
首先, 通过检测MRD精准分层Ⅱ 期肠癌患者, 仅治疗MRD阳性的复发转移高风险患者, 精准施治, 最终两组间生存没差别, 证明基于MRD状态的个性化辅助化疗是可行的, 从个体看, 让原本需要化疗的一半患者免于化疗的痛苦与伤害, 从社会角度看, 能大量节约医疗卫生资源; 其次, 在最终接受化疗的群体中, MRD阳性的复发高风险患者, 辅助化疗联合方案的使用比率大幅度升高, 并较单药化疗明显提高疗效, 弥补了传统治疗模式中的不足。按2022年我国国家癌症中心公布的流行病学资料, 我国每年大约新发结直肠癌50万例, 其中Ⅱ 期大约30%, 就是15万例, 如此庞大的患者基数, MRD的临床及社会价值都更加明显。
然而, 仍有一些问题需要注意。主要有以下几点:
第一, 如何标准化MRD检测的技术平台与方法, 并制定MRD阴性/阳性的标准。DYNAMIC研究中Ⅱ 期肠癌术后ctDNA阳性率为15%, 而采用Signatera技术的Circulate Japan研究中则为7.76%[10], 而笔者团队使用tumor-naï ve固定PANEL技术的既往研究术后1周ctDNA阳性率< 4%[9], 而采用tumor-informed新技术(燃石brPROPHET)后阳性率可增加至6.97%, 这些数据均说明目前行业内仍缺乏统一的共识来标准化ctDNA检测技术以及MRD标准, 如果不解决标准问题, 必将极大的阻碍未来基于MRD干预的前瞻性临床研究的开展。基于笔者采用不同技术研究的个人经验看, 从敏感性的角度看, 定制化的tumor-informed检测技术将会是未来肠癌MRD检测的主流技术; 当然, DYNAMIC研究所采用的检测技术, 严格意义上不属于定制化tumor-informed策略范畴, 因为所有患者均采用固定的15个基因, 并不是定制化。
第二, MRD的最佳检测时间点问题。该研究采用Safe-SeqS方案进行ctDNA-MRD检测, 由于检测技术敏感性不足, 需综合术后4周和7周血检测结果判断MRD状态, 导致ctDNA指导治疗组术后开始进行辅助治疗的中位时间长达83天, 远远长于指南推荐术后8周内开始进行辅助治疗, 这可能对患者辅助化疗产生负面影响。这也是笔者团队研究[9]设计术后1周采血的主要原因, 这样可以在术后3~4周得到MRD检测报告, 最符合目前临床实践中推荐患者开始辅助治疗的时限; 在笔者团队的新研究中(ASCO GI 2023, 摘要号213), 比较过术后1周与3周采血检测MRD的差异, 后者阳性率大约减少1%~2%, 我们需要更多数据来明确MRD最佳的第一次采血时间点, 从而使MRD更好的服务于临床。
第三, 如果计划基于阴性MRD做“ 减法策略” , 则要求ctDNA检测技术敏感性要极高, 保证有极高的NPV(阴性预测值)是关键, 从而真正筛选出那些复发转移极低风险的患者。DYNAMIC研究中ctDNA指导治疗组MRD阴性患者中(根据研究方案设计, 无辅助化疗, 单纯观察), 临床低危Ⅱ 期患者的3年无复发生存率高于高危Ⅱ 期患者[96.7% vs. 85.1%; 风险比(hazard ratio, HR) 3.04; 95%CI 1.26~7.34], T3患者的3年无复发生存率高于T4患者(94.2% vs. 81.3%; HR 2.60; 95%CI 1.01~6.71), 差异均有显著性, 提示现阶段ctDNA状态结合临床风险因素可能是更好的生物标志物, 然而该结果是否由于该研究采用的检测技术敏感性不足而导致“ ctDNA阴性” 患者中假阴性的可能, 目前仍未知。
总之, DYNAMIC Ⅱ 研究是MRD指导肠癌术后辅助化疗探索的里程碑, 创新性毋庸置疑, 吹响了该领域的号角, 但由于目前技术标准、费用等问题尚未完全解决, 所以真正走上临床还需假以时日, 我们期待更多的前瞻性临床研究结果; 我们坚信未来ctDNA-MRD检测一定会绽放异彩, 改变临床实践指日可待!
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|