李羚(1987-),女,四川德阳人,主管技术员,医学学士,主要从事肿瘤放疗技术的相关临床及科研工作。Tel:0838-2418820, E-mail:52320551@qq.com。
目的 比较图像引导放疗(image-guided radiotherapy,IGRT)不同配准方式对肺癌患者摆位误差的影响。方法 选择2019年1月至2020年10月德阳市人民医院收治的64例肺癌患者进行研究。采用双色球法将患者分为2组,各32例。在模拟定位及制订放疗计划后A组采取灰度配准,B组采取骨性配准的方式进行计算机断层扫描(computed tomography,CT)图像配准。比较两组患者自动配准后的平移偏差及旋转偏差,并根据放疗医师手动微调后的配准结果计算并比较平移误差及旋转误差。结果 两组患者旋转误差Rx、Ry、Rz差异均无统计学意义( P>0.05),A组患者平移误差(translation error,G)较B组更小,差异有统计学意义( P<0.05)。两组下肺病灶自动配准结果与手动微调结果差异均无统计学意义,两组上肺病灶旋转误差Rx、Ry、Rz差异均无统计学意义( P>0.05),但A组上肺病灶患者平移误差(G)较B组更小,差异有统计学意义( P<0.05)。结论 在肺癌患者进行IGRT时选择灰度配准在平移误差方面有明显优势,特别是在上肺病灶患者中优势明显,在自动配准基础上加以手动微调可获得满足临床放疗需要的配准结果。
Objective To compare the effects of different image-guided radiotherapy (IGRT) registration methods on the positioning error of patients with lung cancer.Methods 64 patients diagnosed with lung cancer admitted to Deyang People's Hospital from January 2019 to October 2020 were selected for the study. The patients were divided into two groups by the double-color ball method, each with 32 cases. After simulating positioning and formulating the radiotherapy plan, group A adopted gray-scale registration, and group B adopted bone registration for CT image registration. Compare the translational deviation and rotation deviation of the two groups of patients after automatic registration, and calculate and compare the translational error and rotation error according to the radiotherapist's registration result after manual fine-tuning.Results There was no significant difference in the rotation error Rx, Ry, and Rz between the two groups of patients ( P>0.05). The translation error (G) of patient A was smaller than that of group B, and the difference was statistically significant ( P<0.05). There was no statistically significant difference between the results of the two groups'automatic registration of lower lung lesions and manual fine-tuning. There was no statistically significant difference between the two groups' conversion errors Rx, Ry, and Rz of upper lung lesions ( P>0.05). However, the translation error (G) of patients with upper lung lesions in group A was smaller than that of group B, and the difference was statistically significant ( P<0.05).Conclusions When lung cancer patients undergo IGRT, gray-scale registration had apparent advantages in translation error, especially in patients with upper lung lesions. Manual fine-tuning based on automatic registration can obtain registration results that meet the needs of clinical radiotherapy.
肺癌为临床常见的恶性肿瘤, 虽然计算机断层扫描(computed tomography, CT)技术的更新和体检筛查的普及, 更多的磨玻璃结节和肺小结节被发现[1, 2], 肺癌目前已经有早诊早治的趋势, 但仍有不少患者在就诊时已失去最佳的手术治疗时机。放射治疗为肺癌常用的疗法, 随着科学技术进步及设备的更新, 放疗已进入精确定位、精确治疗的调强放疗时代, 但由于器官运动而引起的靶区位移误差及摆位误差可导致患者正常组织受到不必要的放射性照射[3]。图像引导放疗(image-guided radiotherapy, IGRT)为近年新兴的放疗理念, 主要通过加速器上成像设备获取的在线图像与原放疗计划图像匹配而得到实际靶区与设计靶区的摆位误差, 再进行校正而提高靶区的照射精度, 在保证疗效的前提下保护正常组织[4]。锥形束CT(cone beam CT, CBCT)为临床常用的IGRT工具, 目前常用骨性配准与灰度配准两种方式进行自动配准, 但关于肺癌患者CBCT配准方式选择目前尚无统一的标准[5]。配准是IGRT实施过程的关键环节, 只有正确配准才可纠正误差, 配准方式对于配准结果具有重要的影响[6, 7], 因此本研究旨在比较不同配准方式对肺癌患者摆位误差的影响, 以期为临床上此类患者CBCT配准方式的选择提供参考依据。
选择2019年1月至2020年10月德阳市人民医院收治的64例肺癌患者进行研究。纳入标准:经病理学检查确诊为肺癌; 卡氏功能评分在70分以上[8]; 首次接受放疗; 患者已获知情同意。排除标准:非原发性肺癌患者; 患者神志不清, 无法配合医护人员进行相关治疗者。本研究经医院伦理会批准(伦理号:2021-04-137-K01)。采用双色球法将患者分为2组, 各32例。两组一般资料差异无统计学意义(P> 0.05), 见表1。
| 表1 两组患者一般资料比较 Tab.1 Comparison of general data of the two groups of patients |
1.2.1 模拟定位及制订放疗计划
患者在入组后先采用中国核动力研究设计院设备制造厂生产的潜力HMD-IB型模拟定位机进行定位。取仰卧位, 双手交叉上举握住把手, 采用热塑体膜固定体位, 三维激光灯摆位后以9点法标记。在定位完成后使用西门子公司生产的SOMATOM(sensation 64)CT结合瑞迪公司生产的激光复位系统含CT平板床进行扫描。扫描完成后将图像传输至TPS治疗计划系统, 由同一名具副主任医师以上职称的放疗医师进行靶区及脊髓、双肺、心脏、食管等重要危及器官的勾画。采用医科达公司的Monaco系统制订放疗计划。
1.2.2 CT图像的配准方式
由放疗计划的首日起, 每周进行1次图像引导技术与CT图像的配准。患者进入治疗室后, 进行体膜固定, 激光灯定位后扫描移动至治疗部位进行矢状面、冠状面及横断面的实时CT扫描, 使之与放疗计划图像融合后。A组采取灰度配准, B组采取骨性配准的方式进行CT图像配准。配准完成后记录不同配准方式自动配准后系统自动计算与计划靶区的X、Y、Z三个方向的平移误差(X、Y、Z)及旋转误差(x、y、z)。再由1名具副主任医师以上职称的放疗医师对亚临床病灶结构区域配准结果进行评估, 并采取手动配准进行微调使配准结果符合临床需要, 记录微调后的平移误差(X* 、Y* 、Z* )及旋转误差(x* 、y* 、z* ), 参照文献方法[9]计算平移偏差(translation error, G)及旋转偏差(rotation error, R), G=
采用SPSS 22.0统计学软件进行数据分析, 计量资料以(x ± s)表示, 并以独立样本t检验进行分析, 以P< 0.05认为差异有统计学意义。
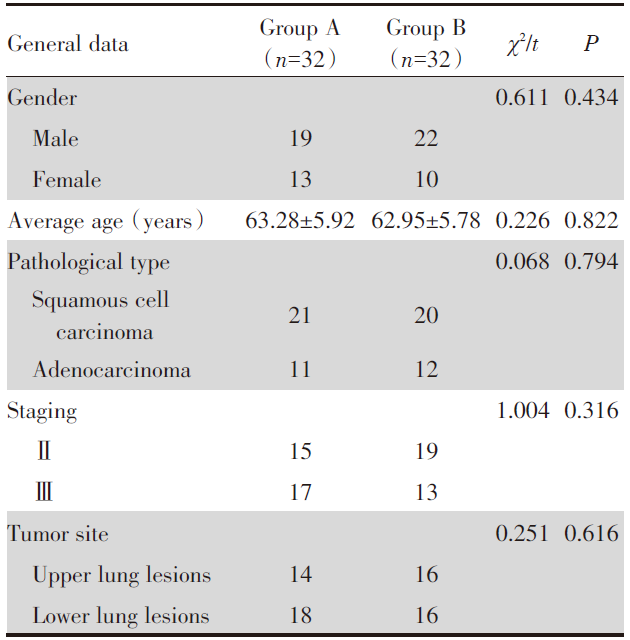
两组患者旋转误差Rx、Ry、Rz差异均无统计学意义(P> 0.05), A组患者平移误差(G)较B组更小, 差异有统计学意义(P< 0.05), 见表2。
| 表2 两组自动配准后手动微调结果的差异比较 Tab.2 Comparison of the differences between the two groups of manual fine-tuning results after automatic registration |
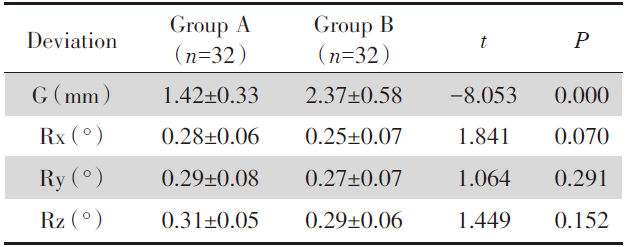
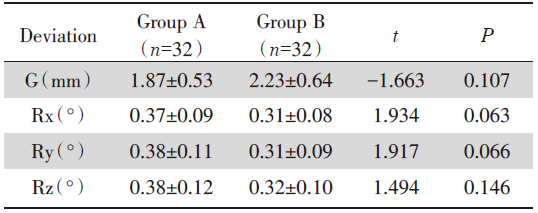
两组下肺病灶自动配准结果与手动微调结果差异均无统计学意义, 两组上肺病灶旋转误差Rx、Ry、Rz差异均无统计学意义(P> 0.05), 但A组上肺病灶患者平移误差(G)较B组更小, 差异有统计学意义(P< 0.05), 见表3、表4。
| 表3 两组下肺病灶自动配准后手动微调结果的差异比较 Tab.3 Comparison of the results of manual fine-tuning after automatic registration of lower lung lesions between the two groups |
| 表4 两组上肺病灶自动配准后手动微调结果的差异比较 Tab.4 Comparison of the differences in the results of manual fine-tuning after automatic registration of upper lung lesions between the two groups |
放疗为肺癌患者常用的治疗手段, 随着设备及技术的发展, 放疗已进入精确时代, 对于影像获取、靶区定位及勾画等方面的要求也越来越高[10]。IGRT技术的开展可有效减少放疗时靶区组织与正常组织运动而引起的误差, 其主要通过加速器上成像设备获取在线图像并与原计划中的图像进行匹配, 以纠正实时摆位误差, 提高靶区照射的精确度, 在最大限度上杀灭肿瘤组织的同时避免正常组织受到照射[11, 12]。尤其是基于平板探测器成像原理的CBCT的使用, 可进一步将放疗的精度提高, 从而提高肺癌的放疗疗效[13]。但临床实践中发现, 不同的配准方式对于CT图像中的感兴趣区域配准结果有较大的影响, 因此本研究旨在通过分析不同配准方式自动配准与放疗医师手动微调配准的差异以评估不同IGRT配准方式对肺癌患者体位摆放误差的影响。
图像配准是对同一患者在不同条件下获取的图像进行比较、融合, 以达到不同条件下的图像在空间变化中可相互映射而使信息融合[14]。目前常用的自动配准方式主要有两种:灰度配准与骨性配准, 两种配准方式各有其优势。灰度配准主要是以灰阶“ 相关比” 程序将灰度框内不同的灰阶值进行运算而配准, 该配准方式对于靶区周围软组织较丰富的恶性肿瘤更为适合; 骨性配准则采用倒角匹配的算法提取骨性特征结构而对影像特征进行分割, 此配准方式适合于靶区邻近骨组织及置入人工标记物者, 有研究者认为肺部距离胸椎、肋骨等骨性特征结构较近, 采用该配准方式不仅速度快还可具有较高准确性[15, 16, 17]。本研究对自动配准与手动配准匹配后的结果比较可看出两种自动配比方式均未达临床治疗的要求, 与手动配比仍有一定的偏差。从偏差结果看, 两组患者旋转误差Rx、Ry、Rz差异均无统计学意义(P> 0.05), A组患者平移误差(G)较B组更小, 差异有统计学意义, 提示灰度配比的平移偏差较小而旋转误差不明显, 与曹璐[9]等的研究结果不一致。究其原因可能与其研究对象为食管癌患者, 虽然食管癌与肺癌均位于胸部, 但与肺癌不同的是食管距离颈椎、腰椎等骨性结构的距离更小且其位置较为固定, 在模拟定位过程中椎体常用作食管癌的定位, 因此骨性算法更适用于食管癌患者的IGRT[18, 19]。而本研究的研究对象为肺癌患者, 此类患者匹配过程中受心脏、膈肌等易受呼吸影响的软组织的影响更大, 灰度配准为运算配准框内不同灰阶值的一种精确配准方式, 对于靶区周围组织为低密度软组织者优势更明显[20]。
除配准方式外患者的体位固定也是引起摆位误差的一个重要原因, 目前临床常用的体位固定方式有热塑体膜固定与真空气垫固定等方式, 本研究所选择的热塑体膜固定方式可有效调节及控制患者呼吸幅度, 使其呼吸处于较平稳的状态而减少因呼吸运动而引起的摆位误差; 同时患者的体型对于热塑体膜固定时的影响较小; 另外热塑体膜固定还可有效减少患者的移动度而提高标记点的参考价值, 因而本研究选择此方式固定患者体位。从不同病灶部位比较结果显示:两组下肺病灶自动配准结果与手动微调结果差异均无统计学意义, 两组上肺病灶旋转误差Rx、Ry、Rz差异均无统计学意义(P> 0.05), 但A组上肺病灶患者平移误差(G)较B组更小, 差异有统计学意义(P< 0.05), 提示在下肺病灶两种配准方式差异不大, 但灰度配准在上肺病灶患者优势更明显, 这可能与下肺病灶距离膈肌更近, 肿瘤的位置易随呼吸的影响, 而上肺病灶受呼吸运动的影响较小, 灰度配准所受到膈肌的影响更小有关。
综上所述, 在肺癌患者进行IGRT时选择灰度配准在平移误差方面有明显优势, 特别是在上肺病灶患者中优势明显, 在自动配准基础上加以手动微调可获得满足临床放疗需要的配准结果。但本研究尚存在一定的不足, 本研究未对左、右肺患者进行独立对比, 因膈肌、心脏等组织的运动对于左、右侧的肺部有不同的影响, 因此可能引起靶区位移的不同, 有必要对此进行进一步的研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|