作者简介:
李家康(1995-),男,广东汕头人,在读硕士研究生,主要研究方向为非小细胞肺癌免疫治疗。李余发(1983-),男,江西鹰潭人,医学硕士,主要研究方向为肿瘤病理。李家康和李余发为共同第一作者,李家康为共同第一作者第一位。
目的 既往关于肿瘤细胞程序性死亡配体1(programmed cell death-ligand 1,PD-L1)的分子机制及其临床价值已经被广泛探索,而关于肿瘤细胞及免疫细胞程序性细胞死亡1(programmed cell death-1,PD-1)的研究仍然缺乏,本文旨在探究早期肺腺癌患者肿瘤组织中免疫细胞、肿瘤细胞PD-1蛋白表达及其与临床病理特征、复发风险的相关性。方法 本研究纳入2010年4月至2021年6月于广东省人民医院就诊的早期肺腺癌患者,并用免疫组化方法对石蜡包埋肿瘤组织上的肿瘤细胞及其周围免疫细胞进行PD-1蛋白表达检测。结果 本研究共纳入446例早期肺腺癌患者,肿瘤细胞PD-1阳性率为2.2%(10/446),免疫细胞PD-1阳性率为18.2%(81/446)。二元logistics回归分析结果显示:免疫细胞PD-1阳性表达在吸烟患者(对比非吸烟者)中更常见[比值比(odds ratio,OR)2.059,95%可信区间(confidence interval,CI)1.138~3.723, P<0.05],肿瘤细胞PD-1阳性表达在Ⅲ期(对比Ⅰ期)的患者中更常见(OR:45.92,95%CI 5.616~375.507, P<0.05),并且肿瘤细胞PD-1表达与免疫细胞PD-1表达之间呈正相关( r=0.58, P<0.05)。Kaplan-Meier生存分析显示,肿瘤细胞PD-1阳性患者复发风险更高[风险比(hazard ratio,HR)6.5,95%CI 1.227~34.590,无病生存率(disease-free survival,DFS): P<0.05],免疫细胞PD-1表达与复发风险无关(DFS: P=0.26)。结论 肿瘤细胞PD-1阳性表达可能是早期肺腺癌患者术后的不良预后因子。
Objective The molecular mechanism of programmed cell death-ligand 1 (PD-L1) in tumor cells and its clinical value had been widely explored. However, the research of programmed cell death-1 (PD-1) on tumor cells and immune cells was still lacking. Our article aimed to explore the PD-1 expression on immune cells and tumor cells respectively. Otherwise, we also explored the correlation of PD-1 and clinicopathological features, and its recurrence risk in patients with early-stage lung adenocarcinoma.Methods In this study, patients with early-stage lung adenocarcinoma were enrolled from Guangdong Provincial People's Hospital between April 2010 and June 2021. PD-1 protein expression was assessed by immunohistochemical (IHC) on tumor cells and immune cells, respectively.Results 446 early-stage lung adenocarcinoma patients meeting the criteria were analyzed. The positive expression rate of PD-1 on tumor cells was 2.2% (10/446), and the positive expression rate of PD-1 on immune cells was 18.2% (81/446). Binary logistics regression analysis showed that positive PD-1 expression on immune cells was more likely to happen in smoking patients (vs. non-smoker) [odds ratio (OR) 2.059, 95% confidence interval (CI) 1.138~3.723, P<0.05], PD-1 positive expression on tumor cells are more likely to happen in stage Ⅲpatients (vs. stageⅠ) (OR: 45.92, 95%CI 5.616~375.507, P<0.05), and there was a positive correlation between PD-1 expression on tumor cells and PD-1 expression on immune cells ( r=0.58, P<0.05). Kaplan-Meier survival analysis showed that the patients of tumor cell PD-1 positive expression had a higher risk of recurrence [hazard ratio (HR) 6.5, 95%CI 1.227~34.590, disease-free survival (DFS): P<0.05], and PD-1 expression on immune cells was not related to the risk of recurrence (DFS: P=0.26).Conclusions The positive expression of PD-1 on tumor cells may be a poor prognostic factor after surgery in patients with early-stage lung adenocarcinoma.
非小细胞肺癌(non-small cell lung cancer, NSCLC)是世界范围内常见的肿瘤, 肺腺癌占NSCLC发生率的85%~90%[1]。免疫检查点抑制剂, 包括细胞程序性死亡受体1(programmed cell death 1, PD-1)/细胞程序性死亡配体1(programmed cell death-ligand 1, PD-L1)、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)抑制剂已经在很多晚期肿瘤中被广泛应用, 例如黑色素瘤、肺癌、胃癌、淋巴瘤等, 也是晚期NSCLC的主要治疗方式[2, 3], 并取得了长期的生存获益。对于局部晚期(ⅢB~ⅢC期)潜在可手术患者, 新辅助免疫治疗也逐渐成为改善患者复发风险和生存预后的一个重要治疗方式[4, 5]。尽管如此, 不管是早期或晚期患者, 仍然存在很大一部分患者对免疫治疗的反应不好[6]。PD-1是一种细胞膜蛋白, 通常表达在活化的免疫细胞上, 例如B细胞、T细胞、NK细胞、Treg细胞上[7, 8], PD-L1则广泛表达于肿瘤细胞上, 也表达于树突状细胞、巨噬细胞、部分B细胞及NK细胞上, 并受到炎症的调控[7]。免疫细胞上表达的PD-1与肿瘤细胞上表达的PD-L1结合, 产生免疫抑制作用[9]。而临床上使用PD-1/PD-L1抑制剂则在一定程度上破坏这种相互作用, 恢复效应性T细胞的功能, 从而达到抗肿瘤增殖的免疫作用[10]。既往关于肿瘤组织细胞上表达PD-L1的研究已经被广泛报道[11, 12, 13], 而关于肿瘤组织上表达PD-1的报道仍然较少, PD-1蛋白分子不仅仅表达在免疫细胞上, 也可以表达在肿瘤细胞上[14, 15, 16, 17, 18, 19]。而PD-1/PD-L1通路又是免疫细胞发生功能的重要一环, 因此, 探究早期肺腺癌患者在肿瘤细胞和免疫细胞上PD-1表达及其预后价值将变得十分有意义。本研究旨在对早期肺腺癌患者肿瘤组织中免疫细胞、肿瘤细胞PD-1蛋白表达与临床病理特征、复发风险之间的相关性进行探究, 以期指导临床实践。
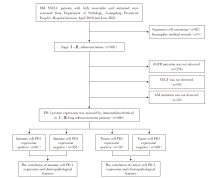
回顾性收集2010年4月至2021年6月于广东省人民医院接受手术切除的肺腺癌患者, 病例筛选流程见图1。通过电子病历系统收集患者的性别、年龄、吸烟史、表皮生长因子受体(epithelial growth factor receptor, EGFR)突变状态、肿瘤TNM分期、体能状态(performance status, PS)评分、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)突变状态、血管内皮生长因子受体(vascular endothelial growth factor, VEGF)强度等临床信息。将性别(男、女), 年龄(≥60岁、<60岁), 吸烟史(是、否), 第8版肺癌分期(Ⅰ、Ⅱ、Ⅲ期), PS评分(0、1、2分), ALK突变状态(是、否), EGFR突变状态(是、否), VEGF强度(阴性、强度+、强度++、强度+++), 肿瘤细胞PD-L1表达(阴性、阳性), 免疫细胞PD-1表达(阴性、阳性), 肿瘤细胞PD-1表达(阴性、阳性)等临床病理特征信息纳入统计分析。
纳入标准:(1)初治的经病理学确诊的Ⅰ~Ⅲ期可手术切除肺腺癌患者, 诊断标准参照中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)非小细胞肺癌诊疗指南; (2)年龄大于等于18岁; (3)同时检测EGFR突变、VEGF强度、ALK突变的患者; (4)在广东省人民医院病理科保存有手术石蜡肿瘤组织标本。
排除标准:(1)近5年中曾有其他恶性肿瘤病史; (2)有其他重大内科疾病患者, 如:药物无法控制的高血压、糖尿病; 肝肾功能异常[谷草转氨酶(aspartate aminotransferase, AST)> 2.5倍正常值, 谷丙转氨酶(alanine aminotransferase, ALT) > 2.5倍正常值], 肌酐清除率(采用Cockcroft-Gault 公式计算) <40 mL/min; 纽约心功能分级Ⅲ级及Ⅲ级以上; (3)病历信息不完整患者, 见图1。
1.3.1 免疫组化检测方法
采用免疫组化法(immunohistochemical, IHC), PD-1抗体采用PD-1(MRQ-22)单克隆抗体(公司:基因科技/Gene Tech)。从每个肿瘤块上切下4 μ m厚的切片, 安装在载玻片上, 烤片60 ℃, 1 h, 脱蜡并复水。接着进行EDTA热抗原修复, 而后样本在压力锅中的EDTA(pH 8.0; PD-1)中微波炉加热10 min。配置PD-1一抗, 室温孵育30 min。滴加二抗, 37 ℃水浴箱孵育30 min。DAB显色8 min。苏木素染色1 min, 风干, 封片。采用已知表达PD-1的肺腺癌标本切片用作阳性对照。
1.3.2 免疫组化结果判断
PD-1蛋白表达在免疫细胞和肿瘤细胞中分别进行评估, 并表示为总肿瘤面积的百分比[20]。只有具有≥100个肿瘤细胞并且仅包括具有部分或完全膜染色的肿瘤细胞的标本才被考虑用于最终分析。当在≥1%的免疫细胞或肿瘤细胞中检测到任何强度的阳性染色时, 则分别被视为免疫细胞PD-1表达阳性或肿瘤细胞PD-1表达阳性。
应用χ 2检验或Fisher确切概率法对肿瘤/免疫细胞PD-1与临床病理特征之间相关性进行单变量分析, 筛选P<0.1的自变量纳入二元logistics回归模型, 进一步分析肿瘤/免疫细胞PD-1表达的影响因素。采用Kaplan-Meier生存曲线和log-rank检验分析无病生存率(disease-free survival, DFS)。本研究中, P<0.05被视为差异具有统计学意义。应用SPSS 20.0进行统计学分析, GraphPad Prism 8.3.0软件进行统计作图。
本研究选取自2010年4月到2021年6月期间, 广东省人民医院病理科确诊完全可手术切除、未经新辅助、辅助治疗的NSCLC患者884例, 排除鳞癌82例、病历资料不全者1例、EGFR突变未检测者276例、VEGF未检测者55例、ALK融合未检测者24例, 见图1。
最终纳入446例早期肺腺癌患者, 患者临床特征包括性别、年龄、吸烟史、EGFR突变状态、TNM分期、PS评分、ALK突变状态、VEGF强度、肿瘤细胞PD-L1。EGFR突变阳性率为59.4%(265/446), 患者临床病理特征见表1。
| 表1 446例早期肺腺癌患者临床病理特征 Tab.1 The clinicopathological characteristics of 446 patients with early-stage lung adenocarcinoma [n(%)] |
免疫细胞PD-1阳性表达率为18.2%(81/446)。卡方检验分析结果显示, 免疫细胞PD-1表达与吸烟状态、肿瘤细胞PD-1显著相关:与非吸烟者相比, 吸烟者更容易出现免疫细胞PD-1表达阳性(P<0.05, 见表2); 与肿瘤细胞PD-1表达阴性相比, 肿瘤细胞PD-1表达阳性者更易出现免疫细胞PD-1表达阳性。
| 表2 免疫细胞PD-1表达与早期肺腺癌患者临床病理特征的关系 Tab.2 The relationship between PD-1 expression of immune cells and clinicopathological characteristics of patients with early-stage lung adenocarcinoma |
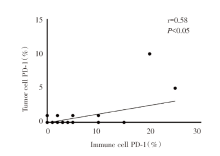
将P<0.1的临床病理特征相关指标纳入二元logistics回归模型中, 多因素回归结果显示:免疫细胞PD-1阳性表达在吸烟患者(对比非吸烟者)中更常见[比值比(odds ratio, OR)2.059, 95%可信区间(confidence interval, CI)1.138~3.723, P<0.05, 见图2], 并且免疫细胞PD-1表达与肿瘤细胞PD-1表达之间呈正相关(r=0.58, P<0.05), 见图3。
 | 图2 影响早期肺腺癌患者免疫细胞PD-1的相关临床病理特征Fig.2 Clinicopathological features affecting immune cells PD-1 expression in patients with early-stage lung adenocarcinoma |
肿瘤细胞PD-1阳性表达率为2.2%(10/446)。卡方检验分析结果显示, 肿瘤细胞PD-1蛋白的表达与分期、免疫细胞PD-1表达、VEGF状态显著相关(P<0.05, 见表3):与Ⅰ期患者相比, 肿瘤细胞PD-1蛋白表达阳性患者在Ⅱ、Ⅲ期患者中更常见; 与免疫细胞PD-1表达阴性相比, 免疫细胞PD-1表达阳性者更易出现肿瘤细胞PD-1表达阳性; 与VEGF阴性相比, 肿瘤细胞PD-1蛋白表达阳性患者在VEGF状态为强度+++的患者中更常见(P<0.05, 见表3)。
| 表3 肿瘤细胞PD-1表达与早期肺腺癌患者临床病理特征的关系 Tab.3 The relationship between PD-1 expression of cancer cells and clinicopathological characteristics of patients with early-stage lung adenocarcinoma |
将P<0.1的临床病理特征相关指标纳入二元logistics回归模型中, 结果显示:对比Ⅰ期患者, 肿瘤细胞PD-1表达阳性在Ⅲ期的患者中更常见(OR:45.92, 95%CI 5.616~375.507, P<0.05, 图4), 并且肿瘤细胞PD-1表达与免疫细胞PD-1表达之间呈正相关(r=0.58, P<0.05), 见图3。
Kaplan-Meier生存分析结果显示, 肿瘤细胞PD-1阳性表达患者的复发风险更高[风险比(hazard ratio, HR)6.5, 95%CI 1.227~34.59, DFS:P<0.05, 见图5], 而免疫细胞PD-1表达与PD-1总人群的复发风险之间没有统计学意义(DFS:P=0.26, 见图6)。男性、分期越晚、肿瘤细胞PD-L1阳性在PD-1人群中的复发风险更高(见图7A~C); 患者年龄、吸烟状态、ALK突变、EGFR突变状态与PD-1人群复发无关(见图7D~G)。
 | 图5 早期肺腺癌患者肿瘤细胞PD-1与复发风险之间的关系Fig.5 Relationship between tumor cells PD-1 expression and recurrence risk in patients with early-stage lung adenocarcinoma |
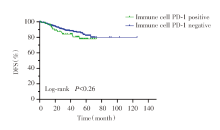 | 图6 早期肺腺癌患者免疫细胞PD-1与复发风险之间的关系Fig.6 Relationship between immune cells PD-1 expression and recurrence risk in patients with early-stage lung adenocarcinoma |
本研究结果提示, 与非吸烟者相比, 吸烟者更容易出现免疫细胞PD-1表达阳性; 与Ⅰ期患者相比, 肿瘤细胞PD-1蛋白表达阳性患者在Ⅱ、Ⅲ期患者中更常见; 与VEGF阴性相比, 肿瘤细胞PD-1蛋白表达阳性患者在VEGF状态为强度+++的患者中更常见。
Zaric等的研究结果显示, 免疫细胞PD-1表达与各临床病理资料之间无显著相关性[20], 与本研究结果一致; 而D'Incecco等的研究显示, 男性(对比女性)患者、吸烟者(对比非吸烟者)、腺癌(对比鳞癌)、EGFR突变野生型(对比EGFR突变型)、KRAS突变型、ALK突变野生型患者更易出现肿瘤细胞PD-1表达阳性[21], 其结果与本研究结果相差较大; 既往不同的研究结果关于肿瘤细胞、免疫细胞PD-1阳性表达与临床病理资料之间的相关性结果差异较大, 可能与人群样本不同, 基线不平衡有关。
本研究结果显示, 肿瘤细胞PD-1阳性的早期肺腺癌患者复发风险更高, 而免疫细胞PD-1表达与早期肺腺癌患者复发风险无关。
既往在黑色素瘤、肝癌病理类型的肿瘤细胞系研究中[19, 22, 23], 肿瘤细胞固有表达的PD-1蛋白分子会促进肿瘤细胞的增殖; 而在NSCLC、肠癌等肿瘤类型的肿瘤细胞系中[19, 24, 25], 肿瘤细胞上固有表达的PD-1蛋白表达则会抑制肿瘤细胞的增殖; 然而, 这些结论都停留在体外肿瘤细胞系或动物模型的水平上, 未将肿瘤细胞周围肿瘤浸润性免疫细胞、患者的临床病理特征结合起来分析讨论, 且样本量较小[23, 24, 25]。在最近的一项研究中, Gan等采用IHC对NSCLC术后的肿瘤组织进行PD-1检测, 结果显示, PD-1表达阳性的患者复发风险更高[26], 这个结论与本研究结果一致, 虽然本研究肿瘤细胞PD-1的样本量仅有2.2%(10/446), 不适合纳入COX多因素回归模型中分析。但另外一个研究也与本结果一致:人体NSCLC肿瘤组织上固有的肿瘤细胞上表达PD-1阳性是早期NSCLC患者的复发的不良预后因素[27]。与以上研究的不同之处在于, 本研究进一步细分了肿瘤组织上肿瘤细胞和免疫细胞PD-1蛋白的表达分析, 而不是仅仅考虑肿瘤组织肿瘤细胞或者免疫细胞上PD-1蛋白的表达。
肿瘤细胞PD-1阳性患者的复发风险更高, 这一结论与既往的研究似乎矛盾。既往的研究显示, 在体外肿瘤细胞系水平或小鼠模型上NSCLC肿瘤细胞固有表达的PD-1蛋白阳性表达会抑制肿瘤细胞生长[19, 25]。但是, 两者的区别在于, 本研究是基于人体肿瘤组织对肿瘤细胞及其周围的肿瘤浸润性免疫细胞进行IHC检测并结合临床病理资料进行分析得到的结果, 而后者仅采用IHC对细胞系或小鼠模型水平进行PD-1检测, 从而验证肿瘤细胞PD-1阳性表达本身抑制肿瘤生长的作用。这些体外实验的研究结果与本研究结果存在的差异, 可能与肿瘤组织周围的浸润性免疫细胞带来的负性调控作用有关, 也可能与免疫细胞释放的负性调控因子的功能作用有关[8, 17, 18, 28, 29], 当然, 也与PD-1与PD-L1、PD-L2之间的亲和力的差异有关[7]; 在肝癌细胞系和肝癌肿瘤组织中也可以看到这种差异现象存在[19, 30], 因而, 不同肿瘤类型的肿瘤组织之间的异质性也将导致肿瘤细胞或免疫细胞上表达的PD-1的功能作用存在差异[19, 22, 24, 25, 30]。
目前PD-1检测使用何种抗体尚未形成统一标准, 使用不同的免疫细胞PD-1抗体检测也会对免疫细胞上表达的PD-1的功能作用存在一定影响。对于PD-1抗体SP269、SNAT105, 研究者发现免疫细胞上存在PD-1的表达对患者预后更差[31, 32]。对于Cell Signaling公司的PD-1抗体D4W2J和PD-1抗体EH33, 免疫细胞PD-1高表达组的患者生存预后更好[33, 34]。但是, 同样是PD-1抗体EPR4877, 免疫细胞PD-1的表达与生存预后没有显著相关性[35]。而其他常见的PD-1抗体, 如:EPR19、CAL15、EH12.2H7等抗体, 则更多针对其他实体瘤的研究, 在肺癌的研究需要进一步展开实验验证。本研究使用PD-1抗体MRQ-22作为检测抗体, 与其他PD-1抗体不同的点在于, 该抗体在众多涉及免疫微环境的研究中被广泛应用, 如Sasse等的研究显示, 霍奇金淋巴瘤患者在接受PD-1抑制剂治疗后产生耐药, 可能与免疫微环境中T细胞上PD-1的上调有关[36]。
因此, 不能只从肿瘤细胞系水平讨论PD-1表达的功能性, 还要结合肿瘤组织周围的免疫细胞功能、不同分子之间的亲和力差异、不同的肿瘤类型的异质性、检测免疫细胞和肿瘤细胞的抗体差异进行讨论。
肿瘤组织周围浸润性淋巴细胞的功能差异巨大[14, 37], 最近的一项研究显示, 肿瘤浸润性淋巴细胞中的表达PD-1的Treg细胞表型能够下调免疫检查点, 达到免疫抑制作用[8], 而在另一项研究中, Zaric等则结合患者临床病理特征资料, 采用IHC对人体早期肺腺癌术后手术肿瘤组织上的免疫细胞行PD-1蛋白检测, 结果显示, 免疫细胞PD-1阴性患者的复发风险更高, 免疫细胞PD-1表达阳性患者复发风险更低[20]; He等的结果也显示, 术后肿瘤组织免疫细胞PD-1表达阳性的患者的复发风险更低[12], 而在另一项研究中, Datar等将人群分为6个队列, 不同队列的结果也差别很大, 其中队列1是检测未经治疗的手术后426例肿瘤组织免疫细胞PD-1蛋白表达, 结果显示, 免疫细胞PD-1表达率小于15%患者的复发风险更高, 这与Zaric等的研究结果大致相同[20, 28], 队列2同样是采用IHC检测未经治疗的手术后304例肿瘤组织免疫细胞PD-1表达情况, 生存分析结果却显示, 免疫细胞上PD-1蛋白表达与患者的复发风险和生存预后之间均没有统计学意义, 队列6是经过PD-1抑制剂治疗后, 采用IHC对90例肿瘤组织标本进行免疫细胞上的PD-1表达的检测, 同样显示免疫细胞PD-1与生存预后没有相关性[28]。而Munari等的研究显示, CD8+的免疫细胞表达PD-1阳性与患者的复发风险和生存预后都没有统计学的相关性[13]。这些结果也与我们关于“免疫细胞PD-1表达与复发风险之间无显著相关性”的结果一致。
不同研究结果出现的肿瘤组织免疫细胞PD-1对预后结果的不同作用, 原因可能是与肿瘤组织周围免疫细胞不同亚群具有不同的功能作用、肿瘤组织不同受体配体亲和力之间存在的差异、肿瘤细胞本身固有的PD-1的抑制肿瘤生长的作用被肿瘤细胞周围抑制性免疫细胞抑制[7, 14, 19]。
免疫细胞PD-1、肿瘤细胞PD-1发生的相关风险因素探究结果显示(二元logistics):吸烟者(对比非吸烟者)更容易出现免疫细胞PD-1蛋白表达阳性; Ⅲ期(对比Ⅰ期患者)的患者更容易出现肿瘤细胞PD-1表达阳性; 而肿瘤细胞和免疫细胞上PD-1蛋白表达呈正相关。在既往的研究中, 很少把免疫细胞、肿瘤细胞上PD-1的表达结合起来分析。因此, 与肿瘤细胞及肿瘤组织周围免疫细胞PD-1表达具有相关性的临床病理变量也能够在本研究中得到进一步阐明。
综上所述, 本研究证实, 免疫细胞PD-1表达阳性患者更容易在吸烟者(对比非吸烟者)、肿瘤细胞PD-1阳性表达者中出现。肿瘤细胞PD-1表达阳性患者更容易在Ⅲ期患者(对比Ⅰ期患者)、免疫细胞PD-1表达阳性患者中出现。本研究的Kaplan-Meier生存分析结果显示, 对于早期肺腺癌患者, 肿瘤细胞PD-1表达阳性患者的复发风险更高, 虽然由于肿瘤细胞PD-1表达率太低, 仅为2.2%(10/446), 不适合纳入COX多因素生存回归模型中分析, 因此这一结论有望在更大的样本量以及其他不同的肿瘤类型组织中得到验证, 并有望指导临床实践。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|