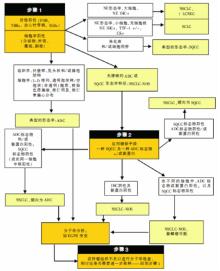
编者按: 2011年伊始, 国际肺癌领域的一个大动作, 是国际肺癌研究协会/美国胸科学会/欧洲呼吸学会联手在《Journal of Thoracic Oncology》上公布了关于肺腺癌的国际多学科分类新标准。
由于肺癌的异质性, 同一治疗手段对肺癌的治疗效果往往是南辕北辙, 由此, 肺癌领域的临床研究和临床处理, 重要的一环是对肺癌的分类和分期以尽量减少其异质性, 从而达到治疗的归一性。从肺癌的分类历史看, 分类逐渐从粗放型向精致型演进。先是上个世纪小细胞肺癌和非小细胞肺癌的简单分类, 而后是早期、局部晚期和晚期的分类, 接着是病理学家对各种亚型的进一步形态学分类。总体而言, 这些分类基本是单学科的自娱自乐, 并没有多学科的融会和贯通, 特别是非小细胞肺癌的病理学分类几乎对治疗和预后没有重大的指导作用, 以至于在相当长的一段时间内, 临床医生只要依据非小细胞肺癌这一粗放的分类就可以进行无差别的治疗了, 这也是半个世纪来肺癌治疗裹足不前的重要原因之一。进入了21世纪, 新的诊断技术新的治疗药物特别是对肺腺癌分子生物学的深入了解, 诞生了新的治疗模式, 对肺癌的分类需求就显得特别迫切了。于是就有了这一由国际著名学会联手精心而作的肺腺癌新分类。
作为这一新分类的审稿人之一, 早在2008年我便接触到这一新分类的内容了, 对其修订过程了解颇多, 也见证了国际许多学者对这新分类的贡献, 也可以说这是国际肺癌学界智慧的结晶。这样, 在肺腺癌新分类发表之际, 我便组织了广东省人民医院、广东省肺癌研究所的专家进行翻译和解读。实际上, 一个新分类的生命力, 更在于在实践中的应用和拓展, 希望我们的解读, 只是作为敲门砖, 大家可以在更大的范围内自由翱翔, 这样的解读也就达到目的了。吴一龙
前言:腺癌是肺癌中最常见的组织学类型。为应对肺腺癌在肿瘤学、分子生物学、病理学、放射学及外科手术的进展, 国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)、美国胸科学会(American Thoracic Society, ATS)及欧洲呼吸学会(European Respiratory Society, ERS)共同发起了关于肺腺癌的国际多学科分类。肺腺癌新分类的方法提供了统一的专业术语及诊断标准, 尤其对细支气管肺泡癌(bronchioloalveolar carcinoma, BAC)、非手术肿瘤小标本的获取途径以及对进行分子标志物与免疫组化研究组织标本的多学科统筹管理尤为重要。
方法:由上述三个组织的肿瘤学家/呼吸病学专家、病理学家、放射学家、分子生物学家及胸外科专家共同组成的国际核心专家小组在美国胸科学会文件开发与实施委员会的指导下, 系统回顾了11 368篇参考文献, 对其中312篇符合特定入选标准的全文进行重点审核和引用。专家组举办了一系列的会议, 讨论新分类方法的进展, 提出推荐意见, 并撰写最新的分类标准。根据“ 推荐等级的评估、制定与评价(grades of recommendation, assessment, development, and evaluation, GRADE)” 体系对关键问题的推荐意见通过证据强度与质量进行分级。
结果:标本分类涵盖手术标本、小活检及细胞学标本。术语“ BAC、混合性腺癌” 不再使用。对于手术标本, 引入了新的概念定义:如原位腺癌(adenocarcinoma in situ, AIS)指孤立小腺癌单纯的伏壁样生长; 微浸润腺癌(minimally invasive adenocarcinoma, MIA)主要为伏壁样生长但浸润≤ 5 mm。这两类患者若接受完全手术切除, 其疾病相关生存率为100%或接近100%。AIS及MIA通常为非黏液性的, 极少数情况下为黏液性的。在使用全面组织学分型(comprehensive histologic subtyping, CHS)后, 浸润型腺癌亚型主要分为伏壁样生长(相当于以前绝大多数混合性腺癌伴非黏液性BAC)、腺泡样、乳头状及实体型; 新增了微小乳头状这一新的组织亚型。其他较少的浸润性腺癌变异型包括浸润性黏液腺癌(之前的黏液性BAC)、胶质样腺癌、胎儿型腺癌及肠腺癌。这种分类方法为小活检及细胞学标本提供了指导, 约70%的肺癌通过此类标准明确诊断。晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者需尽可能明确病理分型, 如腺癌或鳞状细胞癌, 原因包括:(1)腺癌或其他非特殊类型NSCLC需检测表皮生长因子受体(epidermal growth factor receptor, EGFR)突变状态, 此类突变可预测EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)的疗效; (2)相比鳞状细胞癌, 腺癌是培美曲塞疗效的有效预测因子; (3)潜在的致命性大出血可发生在接受贝伐单抗治疗的鳞状细胞癌患者中。如果肿瘤不能通过光学显微镜分类, 那么特殊的检查如免疫组化和/或黏蛋白染色用于进一步的肿瘤分类。应尽量减少“ 未分类(not otherwise specified, NOS)的NSCLC” 等术语的使用。
结论:新的分类方法基于多学科合作, 包括通过临床、分子学、放射学及外科途径诊断肺腺癌, 但主要还是基于组织学。此分类有助于支持临床实践、研究调查及临床试验。由于EGFR突变是EGFR-TKI治疗晚期肺腺癌疗效及无进展生存的有效预测因子, 我们推荐晚期肺腺癌患者常规检测EGFR突变状态。这意味着需要对组织标本进行统筹管理, 尤其针对小活检及细胞学标本, 以便为分子生物学研究提供尽可能多的高质量组织标本。对原发灶、淋巴结及转移灶(TNM)分期中的T分期大小的测量进行了调整, 包括:(1)病理学:根据浸润性肿瘤伴伏壁样生长区域中的浸润成分, (2)放射学:测定“ 部分实体瘤” 中实性成分的大小。
肺癌是全世界癌症发生和死亡的最常见病因。腺癌是绝大多数国家最常见的肺癌组织学亚型, 几乎占肺癌患者数目的一半。肺腺癌中普遍存在临床、放射学、分子学及病理学的多样性, 以至于概念容易混淆, 研究之间难以进行客观比较。虽然在过去十年里, 对腺癌的了解日益深入, 但仍需要建立统一的肺腺癌亚型分类标准, 尤其对于BAC亚型。由于大量资源投入在肺腺癌分子分型和治疗的临床试验中, 所以发展新分类标准刻不容缓, 而且能够进一步促进学科的发展, 增强研究的影响, 改善患者的疗效。肺癌新分类将有助于患者的疗效预测和预后判断。
此项目的一个主要成果是认识到肺腺癌的诊断需要多学科综合手段。世界卫生组织于1967年、1981年及1999年颁布的肺癌分类主要由病理学家为病理学医生而作。在2004年的修订版中, 开始涉及相关的遗传学及临床信息。然而, 伴随着过去6年间我们对肺腺癌在肿瘤内科学、分子生物学及放射学领域理解的日益深入, 迫切需要修订不仅仅基于病理学, 而是基于多学科平台整合的分类标准。以下专业学科间两大主要领域的互相作用, 尤其推动了肺腺癌多学科分类的执行:(1)晚期NSCLC最新分子生物学及肿瘤学进展显示: (a)在肺腺癌患者中, EGFR突变的发现及其对EGFR-TKI疗效预测, (b)需排除鳞癌的诊断以选择合适的患者接受培美曲塞(疗效改善)或贝伐单抗(毒性反应)治疗; (2)在CT中显示的毛玻璃影(ground-glass opacity, GGO)对比实体或混合性占位, 结合在病理学中BAC对比浸润性生长之间的放射-病理学相关性为放射科医师、肺内科医师及外科医师提供新的影像学研究方法预测腺癌的组织学亚型、预后及改善术前评估, 有利于外科干预时机及手术方式的选择。
组织学标准仍然是新分类方法的基础, 但此分类由病理学专家与临床、放射学、分子生物学家及外科专家共同完成。多学科合作导致了专业术语及标准的发展, 不仅定义了病理学实体, 还传递了与治疗策略相关的关键信息(见表1和表2)。此分类也为信息量的集优化和统筹管理标本提供了建议, 不仅做出了最准确的诊断, 还利于管理组织标本, 通过免疫组化和/或分子生物学研究预测疗效和判断预后, 最终将改善患者的治疗效果。
| 表1 IASLC/ATS/ERS肺腺癌手术标本分类 |
| 表2 IASLC/ATS/ERS提议的小活检/细胞学分类 |
此分类方法首次满足了小活检及细胞学检查在肺癌诊断中的需求(表2)。最近有关EGFR突变状态预测EGFR-TKI反应性、毒性反应及疗效的数据确立了从晚期肺癌患者中区分出鳞状细胞癌、腺癌及NSCLC-NOS的重要性。随着经支气管针吸活检(transbronchial needle aspiration, TBNA)、支气管内超声引导(endobronchial ultrasound-guided, EBUS)以及食管超声内镜引导下针吸活检的广泛应用, 大约70%的肺癌可通过小活检或细胞学检查诊断和分期, 而不是外科切除标本。对NSCLC, 绝大多数病理科医师能分辨高分化或中分化的鳞状细胞癌或腺癌, 而对于某些疑难病例则仅给出低分化肿瘤的诊断。此外, 对小活检和/或细胞学标本, 10%~30%的标本仍被诊断为NSCLC-NOS。
表2总结了用于小活检的推荐术语。病理科医师需尽量减少使用NSCLC或NSCLC-NOS等术语诊断小标本、针吸及脱落细胞标本, 要尽可能提供具体的组织学分类以便于肿瘤内科医师制定合理的治疗方案。
在上一版本的WHO分类中, 大多数肿瘤类型的诊断标准基于苏木精和伊红(hematoxylin and eosin, HE)染色检查。但由于组织亚型决定个体化治疗方法, 新分类方法更强调使用和整合免疫组化[如甲状腺转录因子(thyroid transcription factor, TTF)-1/p63染色]、组织化学(如黏蛋白染色)及其他分子标志物研究等多种检测手段。虽然我们需尽可能使用这些手段, 但要普及也是不容易做到的, 所以当仅有HE染色切片可利用时, 新分类亦提供了更简单的检测途径。因此, 该分类也适用于技术资源欠缺的医疗机构。
肺腺癌的国际多学科分类是在IASLC、ATS及ERS共同努力合作下完成的。旨在整合临床、放射学、分子学及病理学多学科对肺腺癌进行分类, 将有助于定义具有不同临床、放射学、分子学及病理学特征的肺腺癌, 目的是识别预后、预测因子以及治疗的靶点。
小组成员包括胸部肿瘤内科、肺内科、放射科、分子生物学、胸外科及病理学专家。上述协会指定小组成员。并由IASLC选出联合主席。根据对肺腺癌特定的兴趣及专长选择小组成员以提供国际多学科的代表。此专家组由一个核心组和一个审核组(见http://links.lww.com/JTO/A59)构成。
专家组在ATS档案发展与执行委员会成员的指导下完成了一次系统性回顾。通过每个特定小组提出本专题相关的关键问题, 并确定检索策略(见http://links.lww.com/JTO/A60)。2008年6月完成检索, 2009年6月更新, 共涉及11 368篇参考文献。这些文献均被仔细审核, 以剔除与肺腺癌分类无关的文章。余下的文章由两位观察员评估, 他们利用基于网络的电子调查程序, 根据预设的符合入选条件的标准收集反馈。这一过程把文章范围缩小至312篇, 经详细审核, 这312篇文章总共包含141项具体特征, 其中17项研究特征、35项临床、48项病理学、16项放射学, 16项分子学及9项外科学特征。这141项特征在电子数据库中进行总结, 该数据库分配给包括写作委员会在内的核心小组成员。根据具体的数据总结选择文章进行审核, 根据“ 推荐等级的评估、制定与评价(GRADE)” 做出推荐。在本文的其余部分, 术语GRADE必须与组织学分级进行区别, 后者用于评估肿瘤病理分化程度。GRADE系统由两大组成部分:(1)对推荐强度进行分级; (2)对证据质量进行评估。推荐的强度是基于权衡获益对比不利因素评估得出的。证据被分为高、中、低、极低4级。证据质量表达了评估作用或联系, 是否足以支持推荐的信心。在审核了所有的文章之后, 写作委员会和每个专题组组长着手发展和提出推荐, 投票支持或反对该推荐, 并在多学科讨论后进行修改。如果取得随机临床试验数据, 我们则假定该证据为高质量, 但当其存在严重的方法学局限性、人群非相关性、结果不一致、评估不精确或强烈怀疑存在发表偏倚时, 则降低其质量等级。如果仅取得可靠的观察性研究数据, 则该证据一开始被定义为低质量。但当有显著疗效或强相关性, 仅有少量、合理的混淆因子, 或存在剂量-效应梯度时, 则提高其质量等级。当我们认为有必要时, 将为干预措施的有效实施考虑更多的因素, 通常代表着必要及标准的医疗程序, 如通过病史询问及体格检查帮助患者作出知情决定、获取书面同意书或良好沟通。但在这种情况下, 我们并没有对证据质量或推荐强度进行分级。
在2008年3月至2009年12月间, 举办了一系列的会议, 绝大多数在纽约的纪念斯隆凯特林癌症中心召开, 讨论与肺腺癌分类相关的议题, 并制定此分类方法。核心组成员为肺腺癌分类预案建立了统一的标准。
涉及此项分类的各个独立项目由个人发起提议, 试图建立数据测试已提议的系统。这些项目包括关于小活检、组织学分级、Ⅰ 期腺癌、来自日本的小腺癌分类、国际多位病理学家关于识别肺腺癌主要组织学形态的可重复性、聚焦于AIS与MIA的分子-组织学相关性及放射-病理学相关性。
本分类中的新提议基于本标准成文时的最佳证据。然而, 由于文献中缺乏通用的诊断标准, 故仍需依据该统一的病理标准开展确认性研究, 以了解腺癌病理学标准与临床、分子学、放射学及外科学特征的相关性。
组织病理学是此分类方法的基础, 但肺癌的诊断是一个多学科的过程, 需与临床、放射学、分子学及外科学密切沟通。由于采用多学科途径制定此分类, 所以我们建议大篇幅改变原来的分类方法, 使肺腺癌的诊断和分类更合理, 并带来治疗获益。
在1999年及2004年WHO分类发表之后, 原来的术语BAC仍广泛应用于一系列的肿瘤, 包括(1)5年生存率100%的单发非浸润周围型小肺癌, (2)5年生存率接近100%的微浸润肺腺癌, (3)混合型浸润性腺癌, (4)之前称为BAC的黏液性及非黏液性亚型, (5)生存率极低、广泛播散的晚期肿瘤。原来BAC这一术语在临床及研究领域的滥用混淆了众多的审稿人和编辑, 需在此次分类中得以修正。
病理学推荐1
我们推荐不再使用“ BAC” 这一术语。(强推荐, 低级质量证据)。
通观此文, 术语BAC(应用于新分类中的多处, 表3)将被“ 原来的BAC” 取代。我们认为这是非常重要的调整, 建议在新术语使用的初期, 括号内“ (原来的BAC)” 将伴随出现。这一调整不仅影响临床实践与研究, 还将影响癌症登记数据的进一步分析。
| 表3 肺腺癌新分类中涉及原来的BAC概念 |
多项研究显示单纯伏壁样生长的单发周围型小腺癌患者可获得100%的5年无疾病生存率。此外, 伏壁样生长为主的腺癌(lepidic predominant adenocarcinomas, LPA)伴微浸润患者也可获得理想的预后。近来的研究表明, 2004年WHO分类中超过90%的肺腺癌被归类为混合型, 故提议使用CHS对含不同组织学成分(腺泡样、乳头状、微小乳头状、伏壁样及实体性)的腺癌进行半定量评估, 并根据主要的组织学亚型分类。这种方法利于诊断组织异质性复杂的肺腺癌, 同时可改善腺癌分子标志与预后的相关性。
对于切除肿瘤新提议的肺腺癌分类总结于表1中。
1999年及2004年WHO分类认为非典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)是肺腺癌的浸润前病变。这是基于多项研究证实AAH伴随发生于5%~23%已切除肺腺癌的肺实质周围。此外, 众多分子生物学研究发现AAH与肺腺癌存在关联, 包括克隆性、KRAS突变、KRAS多态性、EGFR突变、p53表达、杂合体缺失、甲基化、端粒酶过度表达、真核起始因子4E表达、Wnt信号通路中表观遗传的改变及FHIT表达的研究。随着研究的深入, 多中心起源的AAH可同时并存于高达7%的已切除的肺腺癌。
新分类的主要改变是正式明确AIS和AAH同为肺腺癌中的浸润前病变。在浸润前病变分类中, AAH对应鳞状上皮不典型增生, AIS对应原位鳞状细胞癌。
5.1.1 非典型腺瘤样增生
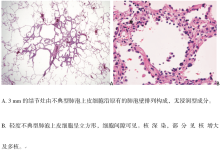
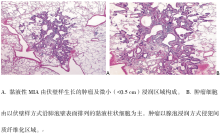
AAH是一类局限性、小(通常0.5 cm或更小)增殖病灶, 由排列在肺泡壁上或排列在呼吸性细支气管壁上的Ⅱ 型肺泡上皮细胞和/或Clara细胞轻度到中度不典型增生引起(图1A、1B)。细胞间隙常见, 由圆形、立方形、低柱状或含圆形或椭圆形细胞核的“ peg” 细胞组成(图1B)。核内包涵体常见。从AAH到AIS的形态学改变是渐进性的。AAH具有特征性的细胞和非典型形态。尽管有些研究者将AAH进一步分为低级和高级, 但我们不推荐这种分级。单纯通过细胞学形态不可能区分AAH与AIS, 两者的差异甚至通过组织学形态也难以完全鉴别。
5.1.2 非黏液性和/或黏液性AIS
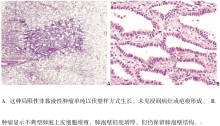
AIS(原来称为BAC病变的一种)是一类局限性小(≤ 3 cm)腺癌, 肿瘤细胞仅沿原有的肺泡结构生长(伏壁样生长), 无间质、血管或胸膜浸润。可表现为乳头状或微小乳头状生长模式, 而肺泡内肿瘤细胞缺如。AIS分为非黏液性及黏液性变异型。事实上, 几乎所有的AIS病例均为非黏液性, 由Ⅱ 型肺泡上皮细胞和/或Clara细胞组成(图2A、2B), 目前未发现区分Ⅱ 型肺泡上皮细胞与Clara细胞的临床意义, 故不推荐这种形态学分类。极少数黏液性AIS病例由含基底核及富含胞质黏蛋白的高柱状细胞组成; 有时它们看起来像杯状细胞(图3A、3B)。在非黏液性及黏液性AIS中都无或无明显核异形(图2B及3B)。肺泡间隔增宽硬化在AIS中常见, 尤其是非黏液性变异型。
根据1999年及2004年WHO分类的严格定义, 符合AIS诊断标准的肿瘤原来归为BAC, 根据1995年Noguchi分类则分为A型与B型腺癌。多项关于单纯伏壁样生长的单发肺腺癌(小于2 cm或3 cm)的观察性研究证实其术后无病生存率为100%。尽管绝大多数这类肿瘤均为非黏液性, 但在1995年Noguchi所报道的28例A型及B型腺癌中有2例为黏液性腺癌。对于黏液性AIS而言, 小病灶(≤ 3 cm)及不连续的局限性边界对于排除周边肺实质粟粒样播散型和/或肺叶实变型病例十分重要。
病理学推荐2
对于单纯伏壁样生长的单发小(≤ 3 cm)腺癌, 我们推荐使用术语“ 原位腺癌” , 这类病变如果接受完全切除, 则可获得100%疾病相关存活率(强推荐, 中级质量证据)。
注意:绝大多数AIS为非黏液性, 极少数为黏液性。
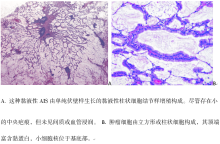
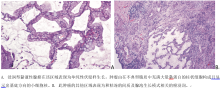
MIA是一类单发小(≤ 3 cm)腺癌, 主要以伏壁样方式生长, 且病灶中任一浸润病变的最大直径≤ 5 mm。MIA通常为非黏液性(图4A、4B、4C), 极少数为黏液性(图5A、5B)。根据定义, MIA为单发且孤立。当肺内其他瘤灶被认为是同时多原发而不是肺内转移时, MIA的诊断标准也可适用于多原发肿瘤。
MIA中可测量的浸润成分定义如下:(1)除伏壁样生长以外的组织学亚型(如腺泡样、乳头状、微小乳头状和/或实体性), (2)肿瘤细胞浸润肌纤维母细胞基质。若肿瘤侵犯淋巴系统、血管、胸膜或含肿瘤坏死, 则排除MIA。若在一个肿瘤内发现多处微浸润灶, 则应测量最大浸润灶的最大径, MIA必须≤ 5 mm。若含多个浸润灶, 则浸润灶的大小并非指所有这些病灶的总和。若组织学切片方式使浸润灶的大小无法测量, 则需通过浸润成分(非伏壁样)的总百分比乘以总的肿瘤大小估计浸润范围。
Noguchi等于1995报道, MIA的术后无瘤生存期可达100%, 其中包括10%原来定义为单纯BAC的单发小肺腺癌出现血管或胸膜浸润。甚至这些有局灶性浸润的肿瘤也显示出100%的术后无瘤生存率。其后Suzuki及Sakurai等分别使用疤痕直径小于5 mm及在细支气管肺泡生长区域存在间质浸润来描述无疾病生存100%的小肺腺癌。最近, Yim、Borczuk 和Maeshima等应用与上述标准相似的方法定义MIA患者, 并证实其疾病相关存活率接近100%或预后良好。虽然黏液性MIA的数据有限, 但仍有黏液性MIA伴少量混合非黏液性成分的个案报道。Sawada等最近报道了局限性黏液性BAC, 但由于病理细节不够具体, 无法确认是否包括了部分黏液性AIS或MIA的病例。最近一系列外科手术切除的单发黏液性BAC无法从组织学上证实是否存在局灶性浸润, 故不能确定AIS和MIA发生的情况, 但≤ 3 cm的8例患者均获得了100%的5年总生存率。对于黏液性AIS而言, 单发肿块、体积小及不连续的局限性边界, 这些重要特征可与邻近肺实质粟粒样播散型和/或肺叶实变型的病例鉴别。
病理学推荐3
对于以伏壁样生长为主, 浸润成分≤ 0.5 cm的单发小(≤ 3 cm)腺癌, 我们推荐新的概念“ 微浸润腺癌” 以描述若病灶接受完全切除, 则患者疾病相关存活率接近100%的这类腺癌(强推荐, 低级质量证据)。
注意:绝大多数MIA为非黏液性, 极少数为黏液性。
AIS与MIA肿瘤大小及标本处理问题
没有完整的肿瘤组织学标本, 无法明确做出AIS或MIA的诊断。如果已获得肿瘤, 则必须按分子学章节里讨论的步骤进行处理。
因为绝大多数关于AIS及MIA的文献只处理2.0 cm或3.0 cm或更小的肿瘤, 因此无法证实完全切除、疑似AIS或MIA且大于3.0 cm的单发肿瘤其无瘤生存率能否达到100%。直至完全取样后的数据证实完全切除的、单发、大于3.0 cm的疑似AIS或MIA腺癌的无瘤生存率为100%, 则推荐使用术语“ 伏壁样为主腺癌, 疑似AIS或MIA” 。在大于3.0 cm这类肿瘤中, 如果没有完全取样, 则最好应用“ 伏壁样为主的腺癌” 这一术语, 并注明“ 临床表现未明和/或不能排除存在浸润成分” 。
由于浸润型腺癌代表了超过70%~90%外科手术切除肺部病例, 新分类最重要的目标就是寻求切实可行的方案, 对异质性复杂、由多种组织学亚型混合而形成的肿瘤进行分类, 也是新分类所面临的最大挑战之一。近年来, 多个研究小组已各自开始根据标本中最主要的组织学亚型对肺腺癌进行分类。这一方案也提供了基于1999年和2004年WHO分类法关于“ 混合性” 肺腺癌更好的分层, 也体现了组织学亚型、分子标志物及临床特征之间的新关联。
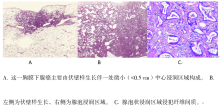
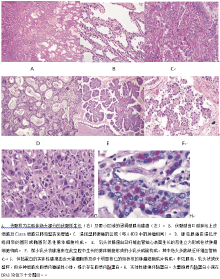
在修订的分类中, 术语“ 为主” 附加于所有浸润型腺癌的类别中, 并取代了“ 混合性腺癌” 的使用, 因为绝大多数这类肿瘤由不同的组织学亚型混合而成(图6A、6B、6C)。鼓励观察者以5%增量的半定量方式记录所有可能出现的亚型, 而并不只是仅关注一种类型(如伏壁样生长)。这种方法也为筛选出主要的亚型提供了基础。尽管以前绝大多数关于此分类的研究使用10%的增量, 但当肿瘤存在两种百分比接近的类型时, 使用5%的增量便于更灵活地选择主要亚型; 也避免了使用10%增量法导致对某些含量小但预后重要成分的忽略, 如微小乳头状或实体性。与单一的主要类型相比较, 当肿瘤含有多种相对均衡的混合类型时, 5%增量法的记录也使临床医师对病理报告的理解更清晰。此外, 该方案也提供了比较多原发腺癌组织学类型的一种方式。这种方法亦为肺腺癌的结构分级奠定了基础。最近26位肺癌病理学专家组织了一项验证性研究对比主要肺腺癌亚型的经典和疑难的病理图像, 证实两者吻合的kappa值分别为0.77± 0.07及0.38± 0.14。
病理学推荐4
对于浸润性腺癌, 我们推荐CHS, 以5%的增量半定量法评估组织学类型, 并选择一种作为主要类型。根据主要类型对不同肿瘤进行分类并报道各亚型所占的百分比(弱推荐, 低级质量证据)。
多发腺癌的组织学对比及对分期的影响
全面的组织学分型对于比较多发肺腺癌、鉴别多原发肿瘤和肺内转移十分重要。对确定多发肺腺癌患者的分期也有关键的作用。以5%的增量记录各种组织学类型所占的百分比, 而不仅仅列出最主要的类型, 使这些数据可用于比较多发腺癌, 尤其是复查发现新发肺肿瘤而无法获得之前肿瘤的病理切片时。除了全面的组织学分型, 肿瘤的其他组织学特征, 如细胞学(透明细胞或印戒细胞特征)或间质特征(粘连或炎症)亦有助于比较多发肿瘤。
病理学推荐5
在多发肺腺癌的患者中, 我们认为全面的组织学分型有利于比较复杂的、异质性混合的腺癌组织, 以确定多发肿瘤是肺内转移还是同时或异时的多中心起源(弱推荐, 低级质量证据)。
典型的LPA通常由沿肺泡壁表面生长的稳定的肺泡样细胞(Ⅱ 型肺泡上皮细胞或Clara细胞)构成, 类似于上述AIS及MIA章节中定义的形态(图6A、6B)。浸润型腺癌至少有一个子灶的最大径大于5 mm。浸润的定义为:(1)除伏壁型以外的组织学亚型(如腺泡样、乳头状、微小乳头状和/或实体性), (2)和侵袭性肿瘤细胞关联的肌成纤维细胞基质(图6C)。若肿瘤侵犯淋巴系统、血管或胸膜或含肿瘤坏死, 则诊断为LPA, 而不是MIA。通常伏壁样生长可发生在转移性肿瘤及浸润型黏液性腺癌中。然而, 在此分类中, 特定的术语“ 伏壁样为主型腺癌(LPA)” 定义为伏壁样生长为主要成分的非黏液性腺癌, 且这类肿瘤已从浸润型黏液性腺癌中独立出来。术语LPA不再用于伏壁样生长为主的浸润型黏液性腺癌中。
在1999/2004年WHO分类中的混合型及Noguchi分类的C型肺腺癌中, 都未评估伏壁样生长(原来的BAC型)所占的百分比, 故在一系列根据上述分类系统的诊断中, 绝大多数LPA掩埋在包括浸润型腺癌为主型在内的异质性肿瘤组织中。然而, 数项研究显示, 在已切除的、单发、含浸润成分的小肺腺癌中, 伏壁样生长和预后良好相关。一项使用此分类法, 关于Ⅰ 期腺癌的最新研究显示, 其5年无复发生存率为90%。
病理学推荐6
对于原来分类为混合性, 其主要亚型由非黏液性BAC组成的非黏液性腺癌, 我们推荐使用术语LPA, 不再继续使用“ 混合性” 这一术语(强推荐, 低级质量证据)。
腺泡为主型腺癌表现为含大量腺体成分, 为圆形或卵圆形伴肿瘤细胞围绕的中央空腔(图6D)。肿瘤细胞及腺腔均可含黏蛋白。腺泡结构亦可由肿瘤细胞圆形聚集而成, 这种肿瘤细胞外周见核分裂相, 中央为无确切空腔的胞质。AIS伴萎陷时很难与腺泡癌区别。然而, 当肺泡结构消失和/或出现肌成纤维细胞基质时, 就认为是浸润型腺泡样腺癌。筛状排列也被认为是腺泡样腺癌的一种特征性改变。
乳头状为主型腺癌显示其主要成分为沿中心纤维血管核心生长的腺癌细胞(图6E)。应与AIS中肺泡壁的弦切面相鉴别。如果肿瘤出现伏壁样生长, 但肺泡腔充满乳头状结构, 则此肿瘤应被归为乳头状腺癌。肌成纤维细胞间质出现与否对乳头状癌的诊断无帮助。
微小乳头状为主型腺癌的肿瘤细胞以乳头状成簇生长, 缺乏纤维血管轴心(图6F)。可孤立存在和/或连接至肺泡壁。这类肿瘤细胞通常较小且呈立方形伴极少量核异形。环样腺体结构可悬浮于肺泡腔中。血管浸润及胸膜浸润常见。可见沙粒小体。
在2004年WHO分类的讨论部分, 提及了微小乳头样肺腺癌, 但几乎没有以此为标题的文献把它列为一种正式的组织学亚型。尽管绝大多数研究使用非常低的阈值将腺癌归为微小乳头状, 包括低至1%~5%, 但最近有研究证实, 微小乳头状腺癌为主的肿瘤与实体性为主型腺癌预后都比较差。所有关于早期微小乳头状肺腺癌的文献数据均提示这是一种预后不良的亚型。支持这种组织学类型具有侵袭性表现的其他证据为:在原发肿瘤中, 微小乳头状腺癌有时仅占肿瘤的一小部分, 而在转移灶中这部分亚型的比例显著增高。
病理学推荐7
在早期腺癌患者中, 我们推荐增加“ 微小乳头状为主型腺癌” 作为一种主要的组织学亚型, 这种亚型和较差的预后相关(强推荐, 低级质量证据)。
伴黏蛋白分泌的实体为主型腺癌主要成分为成片的多边形肿瘤细胞, 缺乏可识别的腺癌表型, 如腺泡、乳头状、微小乳头状或伏壁样生长的结构(图6G)。若肿瘤为100%实体, 则需在两个高倍视野的任意一个中至少有5个肿瘤细胞中出现细胞内黏蛋白, 黏蛋白需经组织化学染色确认(图6H)。实体性腺癌须与鳞状细胞癌及大细胞癌相鉴别, 后两者中仅极少细胞含细胞内黏蛋白。
5.4.1 腺癌组织学变异型更新的依据
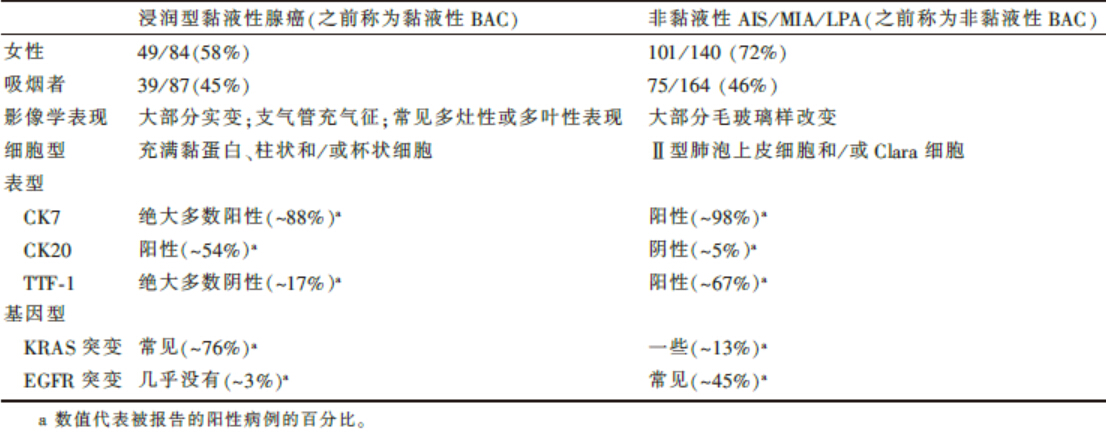
将浸润型黏液性腺癌(原来的黏液性BAC)从非黏液性腺癌中独立出来的依据。多项研究显示之前归为黏液性BAC的肿瘤与归为非黏液性BAC的肿瘤在临床、放射学、病理学及遗传学方面有较大差异(表4)。尤其是黏液性BAC与KRAS突变有着密切的联系, 而非黏液性腺癌更可能出现EGFR突变, 仅偶尔发生KRAS突变(表4)。因此, 在新的分类中, 这类肿瘤被划分至不同的类别(表1)。这类原被称为黏液性BAC的肿瘤现被认为多具有浸润性成分, 故被归为浸润型黏液性腺癌(原来的黏液性BAC)。
| 表4 浸润型黏液性腺癌与原位非黏液性腺癌/微浸润腺癌/伏壁样为主型腺癌的区别 |
将黏液性囊腺癌归入胶样腺癌的依据。之前归为“ 黏液性囊腺癌” 的肿瘤十分罕见, 并可能代表了一系列的胶样腺癌的特征。因此, 我们建议将这类通过影像学和/或光镜下检查发现由单房或少房性结构的腺癌归入胶样腺癌。在做诊断时, 需为这类肿瘤添加注释, 即肿瘤形似原来的黏液性囊腺癌。
从腺癌类型中去除透明细胞及印戒细胞癌的依据。透明细胞及印戒细胞特征现被认为是细胞学改变, 其发生可与多种组织学类型有关。因此, 应记录它们的表现及范围, 但尚无数据证实它们与实体亚型的临床意义密切关联。因此, 不应把它们归类为特殊的组织学亚型。尽管这两种细胞可能与某些分子学特征相关, 如近来发现在高达56%的伴棘皮动物微管相关蛋白4(echinoderm microtubuleassociated protein-like 4, EML4)/间变淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因(EML4-ALK)患者的肿瘤中, 观察到实性肿瘤中含超过10%的印戒细胞特征。
增加肠型腺癌的依据。为引起对此类罕见的原发肺腺癌组织类型的重视, 肠型腺癌被增加至新的分类中, 其可能与结直肠腺癌在形态学及免疫组化特征方面有某些共同点。由于这种相似性, 故需进行临床评估以排除原发胃肠道肿瘤。尚不明确两者是否存在不同的临床或分子学方面的特征。
5.4.2 组织学特征
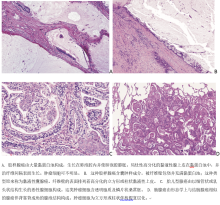
浸润型黏液性腺癌(原来的黏液性BAC)具有独特的组织学表现, 肿瘤细胞具有杯状或柱状细胞形态伴大量胞浆内黏蛋白(图7A、7B)。不典型增生细胞不明显或缺如。肺泡腔常含黏蛋白。这类肿瘤可显示出与非黏液性肿瘤中相同的含伏壁样、腺泡样、乳头状、微小乳头状及实体性生长的异质性混合。报告所含亚型百分比及主要组织学亚型的半定量评估的临床意义与非黏液性腺癌相似, 仍未明确。当发现间质浸润, 则肿瘤细胞可显示出更少的胞浆黏蛋白及更多的不典型增生。可通过下述标准鉴别浸润性黏液腺癌和黏液性AIS及MIA:大小(> 3 cm)、浸润范围(> 0.5 cm)、多发结节或缺乏局限性边界伴粟粒状的周边肺实质播散。
浸润型黏液性腺癌有显著的多中心、多肺叶及双侧肺浸润的趋势, 可能通过气道播散。黏液性与非黏液性混合的肿瘤极少发生; 因此, 应记录浸润型黏液性腺癌的百分比。如果每种成分都超过10%, 则应被归为“ 混合型黏液性及非黏液性腺癌” 。浸润型黏液性腺癌(之前的黏液性BAC)需与原来的黏液性BAC相鉴别, 后者为富含黏蛋白, 而缺乏特征性的杯状细胞或柱状细胞的腺癌。当通过光学显微镜或不符合上述标准的腺癌中的黏蛋白染色鉴别出黏蛋白时, 需用按此分类中合适的术语及标准报告该特征。如“ 伴黏蛋白产生” 或“ 伴黏液性特征” , 而不是“ 浸润型黏液性腺癌” 。
病理学推荐8
对于原来归为黏液性BAC的腺癌, 我们推荐把它们从非黏液性BAC腺癌中独立出来, 按照伏壁样生长与浸润性生长范围的比例不同, 分为黏液性AIS、黏液性MIA或对于明显浸润型肿瘤使用“ 浸润型黏液性腺癌” (弱推荐, 低级质量证据)。
胶样腺癌存在大量细胞外黏蛋白池, 使肺泡腔膨胀, 并伴有肺泡壁的破坏(图8A)。黏蛋白池含成簇的分泌黏蛋白的肿瘤细胞, 其可仅构成整个肿瘤不明显的一小部分(图8A)。肿瘤细胞可由杯状细胞或其他分泌黏蛋白的细胞组成。胶样腺癌更多见于其他腺癌的混合亚型中, 而不是作为一种单纯的类型, 仅当其占据肿瘤的主体时, 被归为胶样腺癌, 并应记录其他成分的百分比。囊肿的肉眼及组织学特征包括于一系列的胶样腺癌中, 但在绝大多数病例中, 这是一种局灶特征。之前报道为黏液囊性腺癌的病例极为罕见, 目前应归为胶样腺癌伴囊。囊肿充满黏蛋白, 被杯状细胞或其他分泌黏蛋白的细胞包绕(图8B)。这种排列的上皮细胞可为不连续的, 且可被包括肉芽肿样反应或肉芽肿组织在内的炎症取代。肿瘤上皮的不典型细胞通常极少。
胎儿型腺癌由管状腺体组成, 后者由富含糖原的无纤毛细胞构成, 形似胎儿肺小管(图8C)。核下空泡常见且为特征性表现。腔内可见鳞片状桑葚胚。绝大多数分级较低, 预后较好, 也可发生高分级肿瘤。当与其他的组织学亚型混合发生时, 肿瘤应根据主要成分进行分类。此类肿瘤通常发生于较年轻的患者。胎儿型腺癌的独特之处在于, β -catenin基因突变可导致此类肿瘤出现, 可通过免疫组化, β -catenin特异性抗体在上皮细胞异形核及胞浆染色显示。Nakatani及Sekine等研究提示Wnt信号通路β -catenin的上调, 在低分级胎儿型腺癌及双相肺母细胞瘤中十分重要, 与高分级胎儿型腺癌正相反。
肠分化可发生于肺腺癌中, 当成分超过50%时, 则该肿瘤应被归为肺腺癌伴肠分化。肠型腺癌与结直肠腺癌在形态学及免疫组化方面特征相似。与转移性结直肠腺癌一样, 这类肿瘤与一些构成原发性肺腺癌伏壁样生长的成分存在组织学异质性。记录各种成分的百分比对诊断是有帮助的。肠型腺癌由腺体样和/或乳头状结构构成, 有时伴筛状型, 由绝大多数为高柱状伴核假复层、腔内坏死及核碎裂的肿瘤细胞排列而成(图8D)。低分化肿瘤可含更多的实体成分。这类肿瘤显示出至少一个肠分化的免疫组化标志物(CDX-2、CK20或MUC2)。在近半数病例中出现CK7的持续阳性及TTF-1的表达, 有助于与转移性结直肠腺癌相区别。CK7阴性的病例亦可发生。组织学与结直肠腺癌相似, 但缺乏肠分化免疫组化标志物的原发性肺腺癌诊断为肺腺癌伴肠型比肺腺癌伴肠分化可能更准确。
这部分内容适用于大部分局部晚期或转移性肺癌患者。因其决定是否适用分子学检测及影响特定的治疗, 故需要改良鉴别鳞状细胞癌和腺癌的方法。当形态学特征不清晰时, 目前临床上对应用额外的病理学手段完善晚期肺癌患者的小活检(气管镜、针吸或细针穿刺活检)及细胞学标本的诊断需求增大。腺癌患者应检测EGFR突变状态(证据见临床推荐章节), 因为EGFR突变的肿瘤患者可接受一线TKI治疗。腺癌患者也适合接受培美曲塞或含贝伐单抗的化疗方案(见临床推荐章节)。
病理学推荐9
对于小活检及细胞学检查, 我们推荐尽可能将NSCLC分为更具体的组织学类型, 如腺癌或鳞状细胞癌(强推荐, 中级质量证据)。
所有当前证明在晚期肺癌患者中区分组织学类型重要性的数据均仅通过光学显微镜获得。因此, 为临床工作、科学研究及临床试验而做出的诊断应用同一种方式记录, 这样就会很清楚病理科医师是如何做出决定:仅基于光学显微镜或光学显微镜加特殊的研究手段。
最佳临床实践的病理学考虑因素
(1)当应用小活检或细胞学标本联合特殊研究手段做出诊断时, 应说明诊断是仅基于光学显微镜还是需要特殊染色。
统筹使用小活检或细胞学标本非常重要, 例如:应尽可能使用最少量的标本做出正确的诊断, 从而为潜在的分子学研究保存更多的肿瘤组织(图9)。为做出腺癌或鳞状细胞癌的诊断而使用大量组织标本的方法, 如多种免疫组化染色或分子学研究, 并不比常规光学显微镜联合有限的免疫组化检查更具优势。
最佳临床实践的病理学考虑因素
(2)管理组织标本不应仅仅为了诊断, 而且还应为分子学研究提供尽量多的组织标本。
(3)为指导晚期肺腺癌患者的治疗, 每个医疗机构都应成立一个多学科团队, 相互协调选择最佳的方法获得及制备活检/细胞学标本以提供迅速高效的诊断及分子标志物结果。
当符合2004年WHO分类中的具体诊断标准时, 应利用活检及细胞学标本做出鳞状细胞癌及腺癌的诊断。然而, 对于不符合这些标准的肿瘤, 则需应用表2及图9中概述的新术语及标准。
由于组织学异质性, 小活检和/或细胞学标本不能代表整个肿瘤, 与最终通过手术切除标本做出的组织学诊断可能存在差异。此外, 符合腺鳞癌诊断标准的组织学类型占所有已切除NSCLC的比例不足5%。小活检/细胞学检查面临的一个更常见的困难是对低分化肿瘤进行分类, 其在光学显微镜下难以识别出明确的分化。由于组织异质性的存在, 也不可能通过小活检或细胞学检查诊断AIS、MIA、大细胞癌或多形性癌, 因为只有手术切除标本才能对这些诊断做出解释。术语“ 大细胞癌” 已用于一些临床试验, 由于不能通过晚期肺癌患者获取的小活检或细胞学标本做出这一诊断, 故该诊断的病理学标准尚未明确定义, 且尚不清楚这类肿瘤应如何与NSCLC-NOS区别。
最佳临床实践的病理学考虑因素
(4)不应在小活检或细胞学标本中做出AIS或MIA的诊断。若有非浸润类型出现在小活检中, 则应被判断为伏壁样生长模式。
(5)术语大细胞癌不应用于小活检或细胞学标本的诊断, 因在此类诊断中, 肿瘤需彻底全面取样以排除存在分化型成分。
在标本显示为NSCLC, 但缺乏明确的鳞癌或腺癌形态学表现的病例中, 免疫组化可完善诊断(图9, 步骤2)。在小活检中, 为保存尽可能多的组织标本以便用于分子学检测, 染色检查应尽量减少。我们意识到可能会发展出新的标志物, 故建议最初的评估仅用一种腺癌及一种鳞癌标志物。目前, TTF-1似乎是腺癌的最佳独立标志物。TTF-1作为肺泡上皮细胞标志物提供了重要的价值, 有助于在75%~85%的肺腺癌中证实肺部原发灶的来源。这对鉴别其他部位, 如结肠或乳腺来源的转移性腺癌问题十分有效。淀粉酶-过碘酸雪夫氏染色亦相当有价值。p63一直被认为是鳞状细胞样组织学可靠的标志物, CK5/6也有一定作用。细胞角蛋白7在腺癌中比在鳞状细胞癌中更易染色。其他抗体(34β E12和S100A7)对鳞状细胞分化的特异性及敏感性均较低。对活检被诊断为NSCLC而最终进行了手术切除的病例证实了上述数据, 这些数据也同样适用于绝大多数的针吸标本。可以利用细胞核和细胞质混合型抗体(TTF-1/CK5/6或p63/napsin-A)通过少量的免疫组化试验进行复合多抗研究。腺癌标志物(如TTF-1)和/或黏蛋白阳性且鳞状细胞样标志物(如p63)阴性的病例应被归为“ NSCLC, 倾向为腺癌” (图10A-C), 以及那些至少中度弥漫性染色显示鳞状细胞样标志物阳性, 且腺癌标志物和/或黏蛋白染色阴性的病例则被归为“ NSCLC, 倾向为鳞状细胞癌” , 并注释此分化是通过光学显微镜和/或特殊染色发现的。这两种染色组合通常相互排斥。如果腺癌标志物如TTF-1为阳性, 则不管是否表达鳞状细胞标志物, 肿瘤仍应归为“ NSCLC, 倾向为腺癌” 。如果在肿瘤不同细胞群中腺癌和鳞癌标志物分别表达阳性, 则此肿瘤为腺鳞癌。若肿瘤组织不足以进行分子学检测, 则需要对患者重新进行活检并检测以指导治疗(图9, 步骤3)。
多学科交流有助于指导病理科医师在肺腺癌中评估小活检和/或细胞学检查。例如, 若从1例CT发现毛玻璃样结节(ground-glass nodules, GGN)的亚裔、女性、不吸烟患者中活检显示NSCLC-NOS。由于此肿瘤很可能为腺癌且伴有EGFR突变, 病理科医师应获悉以上临床信息。
细胞学检查在诊断肺癌中是一种十分有价值的手段, 尤其在鉴别腺癌与鳞状细胞癌时。最近的一项研究中, 共192例患者术前接受细胞学诊断, 明确、倾向及非分类诊断分别占88%、8%及4%。当与随后的手术切除标本对比时, 细胞学诊断的准确性为93%, 在明确诊断组中准确性更是高达96%。对于腺癌及鳞状细胞癌的病例, 仅3%的病例未经分类, 总准确率为96%。在9%的患者中使用免疫组化检查时, 准确率达100%。
只要有可能, 细胞学就应联合组织学一起用于小活检标本的诊断(图10D)。在另一项研究中, 评估小活检连同细胞学检查做出的腺癌、鳞状细胞癌及未分类的(NSCLC-NOS)诊断, 细胞学检查的结果分别为70%、19%及11%, 活检的结果分别为72%、22%及6%。当细胞学联合活检时, 诊断为NSCLC-NOS的病例百分比大幅下降至4%。在小部分病例中(< 5%), 细胞学检查在区分腺癌及鳞状细胞癌时比组织学检查能提供更丰富的信息。在这两项研究中, 导致难以做出具体诊断的最主要因素均为低分化、标本细胞结构少及鳞状细胞样组织学。
最佳临床实践的病理学考虑因素
(6)当拥有配对的细胞学及活检标本时, 两者应被共同审核以获得最明确及一致的诊断。
由于频繁显著的间质反应, 故活检中肿瘤细胞的容量也可较小, 以至于无法为分子学分析提供足够的标本。针吸或体腔积液来源的标本可比同时活检的小标本获得更多的肿瘤细胞, 因此任何细胞学检查阳性的标本都应被保存成细胞块, 以完成免疫组化及分子学研究。因此, 在做诊断时应审慎地使用这些材料, 从而为可能的分子学研究提供尽可能多的标本。在最近一项研究中, 从128例肺癌细胞学标本制备的细胞块中提取的材料有126例(98%)适用于EGFR及KRAS突变的分子学分析。
最佳临床实践的病理学考虑因素
(7)应从包括胸水在内的细胞学标本中制备细胞块。
由于通过常规形态学和/或免疫组化检查未发现明确分化, 故仍有少量病例维持NSCLC-NOS的诊断(图9, 步骤2)。在腺癌标志物(如TTF-1)阴性且鳞状细胞样标志物局灶性弱染色的肿瘤中, 最合适的方法是将此肿瘤归为NSCLC-NOS, 而不是倾向为鳞状细胞癌的NSCLC。这些病例可能从多学科综合讨论中获益: (a)若分型将影响治疗, 则决定进一步取样的需要; (b)若分子标志物分析将决定治疗, 则检测这些标志物; (c)是否存在非侵袭性特征, 如影像学特征(如周围GGN支持腺癌诊断)倾向某些肿瘤亚型; (d)是否存在临床表型(如女性、不吸烟者及亚裔)可帮助决定进一步的治疗(图9, 步骤3)。
病理学推荐10
应尽可能减少使用NSCLC-NOS, 并建议该术语仅用于通过形态学和/或特殊染色无法做出更明确的诊断时(强推荐, 中级质量证据)。
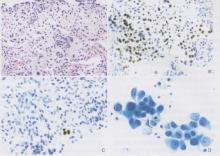 | 图10 小活检及细胞学检查中的腺癌 低分化非小细胞肺癌, 倾向为腺癌。 A. 空心针穿刺活检显示实体性生长且形态学上缺乏任何腺泡、乳头状或伏壁样类型的表现。黏蛋白染色亦为阴性。B. TTF-1染色强阳性。C. p63染色局灶性阳性。TTF-1的弥漫强阳性与局灶性p63染色阳性提示为腺癌。在此病例中, EGFR突变为阳性。D. 不同腺癌的细胞学显示大体积、胞质丰富、核明显的恶性细胞以腺泡结构生长。 |
最佳临床实践的病理学考虑因素
(8)术语“ 非鳞状细胞癌” 不应出现在病理科医师的诊断报告中。这只是临床医师用以定义组织学类型不同但接受相似治疗的患者的分类方法; 在小活检/细胞学检查中, 病理科医师应将NSCLC分为腺癌、鳞状细胞癌、NSCLC-NOS或其他列于表2或图9中的术语。
极少数情况下, 小标本可显示出鳞状细胞癌及腺癌两种形态学特征, 或免疫组化表达出鳞状细胞样及腺癌两种标志物; 此类肿瘤应被称为“ NSCLC-NOS” 伴注释记录显示伴发腺样及鳞状细胞分化的特征, 并注明是通过光学显微镜还是免疫组化发现的。由于p63表达发生在高达三分之一的腺癌中, 故在缺乏鳞状细胞形态学表现的肿瘤中, 几乎所有显示出p63及TTF-1共表达的肿瘤都是腺癌。肿瘤也可能是腺鳞癌, 但在没有手术切除标本显示出两种成分至少各占10%的前提下, 不能做出此诊断。若在不同肿瘤细胞群中可见TTF-1及p63阳性, 则可能比这些标志物共同表达在同一肿瘤细胞中更倾向于诊断腺鳞癌。
当前, 推荐EGFR突变检测及候选培美曲塞或贝伐单抗治疗是基于以下诊断: (1)腺癌, (2)NSCLC-NOS, 倾向为腺癌, (3)NSCLC-NOS(见之后的临床推荐章节)。因此, 对于绝大多数NSCLC, 首诊病理科医师在解释小活检及细胞学标本时, 需关注肿瘤是否为明确的鳞状细胞癌或倾向为鳞状细胞癌的NSCLC。所以, 当形态学或免疫组化结果模棱两可时, 病理科医师需谨记, 鳞状细胞癌或倾向鳞状细胞癌NSCLC的诊断将把它们排除在由组织学决定的分子学检测或相应化疗方案之外。在这种情况下, 最佳的方式是诊断倾向为NSCLC-NOS, 以允许患者符合前文提及的治疗选择。我们也希望, 在不久的将来会出现对鳞状细胞癌患者有效的分子靶向治疗。
最佳临床实践的病理学考虑因素
(9)与表2及图9中其他组织学及术语相比, 上述腺癌的分类方法应用于常规诊断及更多的研究与临床试验中, 因此存在统一的与肿瘤亚型相关的疾病分类, 且数据可根据仅凭光学显微镜做出诊断结合特殊染色诊断进行分层。
显示出肉瘤样癌特征, 如明显的核多形性、恶性巨细胞或梭形细胞形态学表现的病例, 如同时伴有明确的腺癌或鳞癌特征, 仍应优先归为可能会影响治疗决策的腺癌或鳞状细胞癌。然而, 多形性癌、癌性肉瘤及母细胞瘤不适合通过难以评估混合性组织类型的小标本确诊。但是, 如果小活检显示腺癌伴多形性的可能, 则应添加注释, 如“ NSCLC, 倾向为腺癌, 伴巨细胞和/或梭形细胞特征” (依据其识别特征)。
最佳临床实践的病理学考虑因素
(10)显示出肉瘤样特征, 如明显的核多形性、恶性巨细胞或梭形细胞形态学表现的肿瘤, 如果出现清晰的腺样或鳞状细胞样特征, 则应优先归类为腺癌或鳞状细胞癌, 因其会影响治疗。若未出现此类特征, 应使用术语“ 低分化NSCLC伴巨细胞和/或梭形细胞特征” (依据其识别特征)进行诊断。
一些NSCLC病例可显示出神经内分泌(NE)形态学表现; 应利用NE标志物(CD56、嗜铬粒蛋白和/或突触素)进行评估从而做出大细胞NE癌(LCNEC)的诊断建议。但通过小活检很难做出LCNEC的明确诊断, 故术语“ 可能为LCNEC的NSCLC” 通常为最合适的诊断。在那些缺乏NE形态学表现的病例中, 我们不推荐使用常规NE标志物染色, 因为NE分化的免疫组化证据在另一些明确诊断的腺癌及鳞状细胞癌中似乎不能影响预后或治疗。
最佳临床实践的病理学考虑因素
(11)NE免疫组化标志物应仅在疑似NE形态学表现的病例中进行检测。若无疑似NE的形态学表现, 则不应行NE标志物检测。
对于腺癌而言, 尚没有大家普遍接受的组织学或细胞学分级系统。绝大多数腺癌分级的文章都没有应用明确的组织学标准。肿瘤的总体分级通常由分级最差的成分决定。仅少数研究评估了详细的形态学分级系统。主要方法均基于结构和/或细胞核特征。然而, 下述组织学特征是分级系统成分中有前景的候选。基于结构特征, 报道了下述预后关系:差(实体性与微小乳头状)、好[非黏液性伏壁样(之前的BAC)]及中等(乳头状与腺泡样)。因此, 全面的组织学分型方法与浸润型肿瘤根据主要亚型而确定的亚分类可以成为制定肺腺癌结构分级的简单方法, 类似于前列腺癌的Gleason分级系统。基于细胞核标准, 初步的数据提示较差的预后与大细胞核及核大小与形状不一致有关。正如前所述, 组织学分级不应与表示推荐强度和衡量证据质量的GRADE法混淆。
随着基于分子标志物个体化靶向治疗时代的到来, 需多学科的综合策略获得及保存组织标本, 并促使研究顺利完成, 如DNA测序分析、荧光原位杂交(fluorescence in situ hybridization, FISH)及某些以RNA为主的研究。然而, 由于研究机构之间在基础设施及专业方向上存在广泛差异, 本文难以提供明确的指导。这一过程始于获得组织标本的方法(空心针穿刺、经支气管活检以及外科手术切除), 后续在病理科标本的制备, 旨在为分子学分析提供材料以及通过病理报告交流分子学研究结果。
如果部分取样肿瘤在进行分子学研究前迅速冰冻, 则需考虑切除标本时涉及的一些因素。绝大多数的分子学研究可在福尔马林固定石蜡包埋的组织标本中完成, 仅某些技术如比较基因组杂交技术(comparative genomic hybridization, CGH)及基因表达谱分析需冻存组织标本。如果冰冻组织从伴有伏壁样为主型肿瘤中制备获得, 因其需与AIS或MIA鉴别诊断, 故应明确冰冻切片中是否含有浸润成分。应考虑病灶的CT及大体表现以保证取样时可获得CT上所显示为部分实性肿瘤的实性成分。另一种方法是从保存于冰箱的组织中完成冰冻切片。
小活检和/或包括胸水在内的细胞学标本可用于众多分子学分析。EGFR突变检测及KRAS突变检测都可在这些标本中快速进行。福尔马林固定石蜡包埋的标本可有效用于聚合酶链反应为主的突变检测及FISH或原位显色杂交(chromogenic in situ hybridization, CISH)检测, 后者用于检测基因扩增及免疫组化。细胞学涂片可用于免疫组化及某些分子学研究, 但若能获得细胞块, 则更为理想。人工或激光显微切割可为分子学研究富集肿瘤细胞。EGFR突变状态的评估有助于选择患者接受EGFR-TKI的治疗。在临床试验背景下的分子学检测可根据基因表达或标志物对特定细胞毒性药物的敏感性对患者进行分层, 如剪切修复交叉互补基因1(excision repair cross-complementation group 1, ERCC1)与BRCA1对铂类, 核苷酸还原酶M1(RRM1)对吉西他滨或胸腺嘧啶核苷酸合酶(TS)对叶酸拮抗剂。
(1)我们推荐不再使用“ BAC” 这一术语(强推荐, 低级质量证据)。
(2)对于单纯伏壁样生长的单发小(≤ 3 cm)腺癌, 我们推荐使用术语“ 原位腺癌” , 用于描述若病灶完全切除, 可获得100%疾病特异性生存的患者(强推荐, 中级质量证据)。注意:绝大多数AIS为非黏液性, 极少数为黏液性。
(3)对于主要以伏壁样生长及≤ 0.5 cm小浸润灶的单发小(≤ 3 cm)腺癌, 我们推荐新的概念“ 微浸润腺癌” 以描述若病灶完全切除、疾病特异性生存接近100%的患者(强推荐, 低级质量证据)。注意:绝大多数MIA为非黏液性, 极少数为黏液性。
(4)对于浸润性腺癌, 我们推荐全面的组织学分型, 以5%的增量半定量评估组织学类型, 并选择其中一种作为主要类型。根据主要类型对不同肿瘤进行分类并报道各亚型所占的百分比(弱推荐, 低级质量证据)。
(5)在多发肺腺癌的患者中, 我们认为全面的组织分型可用于比较复杂的、组织异质性丰富的混合亚型, 以明确肿瘤是肺内转移还是同期或异时的多中心起源(弱推荐, 低级质量证据)。
(6)对于原来分为混合亚型的非黏液性腺癌, 主要构成原来的非黏液性BAC, 我们推荐使用术语LPA, 不再使用术语“ 混合亚型” (强推荐, 低级质量证据)。
(7)在早期腺癌患者中, 我们推荐添加“ 微小乳头状为主型腺癌” 作为一种主要的组织学亚型, 这种类型与较差的预后相关(强推荐, 低级质量证据)。
(8)对于原来归为黏液性BAC的腺癌, 我们推荐把它们从非黏液性BAC的腺癌中独立出来, 按照伏壁样生长与浸润性生长成分之间的比例, 将它们分为黏液性AIS、黏液性MIA或对明显浸润型肿瘤使用“ 浸润型黏液性腺癌” (弱推荐, 低级质量证据)。
(9)对于小活检及细胞学检查, 我们推荐只要有可能, 应将NSCLC进一步分为更具体的组织学类型, 如腺癌或鳞状细胞癌(强推荐, 中级质量证据)。
(10)我们推荐尽可能减少使用NSCLC-NOS, 并建议该术语仅用于通过形态学和/或特殊染色无法做出更明确的诊断时(强推荐, 中级质量证据)。
最佳临床实践的病理学考虑因素总结
(1)当利用小活检或细胞学标本联合特殊研究做诊断时, 应说明诊断是仅基于光学显微镜还是需要特殊染色。
(2)管理组织标本不仅为了诊断, 而且还需为分子学研究提供尽量多的组织标本。
(3)为指导晚期肺腺癌患者的治疗, 各个医疗机构都应成立一个多学科团队, 相互协调选择最佳的方法获得及制备活检/细胞学标本以提供迅速高效的诊断及分子学结果。
(4)不应通过小活检或细胞学标本做出AIS或MIA的诊断。若在小活检标本中发现非浸润型类型, 则应被诊断为伏壁样生长。
(5)大细胞癌不应用于小活检或细胞学标本的诊断, 因在此类诊断中, 肿瘤需彻底全面取样以排除其他分化型成分。
(6)当可获取配对的细胞学及活检标本时, 两者应被共同审核以获得最明确及一致的诊断。
(7)应通过包括胸水在内的细胞学标本中制备细胞块。
(8)术语“ 非鳞状细胞癌” 不应出现于病理科医师的诊断报告中。这只是临床医师用以定义组织学类型不同但接受相似治疗的患者的分类方法; 在小活检/细胞学检查中, 病理科医师应将NSCLC分为腺癌、鳞状细胞癌、NSCLC-NOS或其他列于表2 或图9中的术语。
(9)与表2及图9中其他组织学及术语相比, 上述腺癌的分类方法应用于常规诊断及更多的研究与临床试验中, 因此存在统一的与肿瘤亚型相关的疾病分类, 且数据可根据仅凭光学显微镜做出诊断对比特殊染色的诊断进行分层。
(10)显示出肉瘤样特征, 如明显的核多形性、恶性巨细胞或梭形细胞形态学的肿瘤, 如果出现清晰的腺样或鳞状细胞样特征, 则应优先诊断为会影响治疗选择的腺癌或鳞状细胞癌。若未出现此类特征, 应使用术语“ 低分化非小细胞肺癌伴巨细胞和/或梭形细胞特征” (依据其识别特征)进行诊断。
(11)NE免疫组化标志物应仅在疑似NE形态学表现的病例中进行检测。若无疑似NE的形态学表现, 则不应行NE标志物检测。
(1)MIA的诊断标准是基于有限的数据, 需进一步的确认。未解决的问题包括测量浸润成分范围的最佳方法?0.5 cm是最佳的截断值吗?若出现多处浸润, 应使用最大浸润灶的最大径线, 还是病灶总大小乘以浸润成分的百分比?疤痕大小或主要的间质粘连及炎症如何影响浸润成分范围?与非黏液性肿瘤相比, 黏液性MIA的诊断标准是否不同?
(2)伏壁样生长也可包含毗邻带有浸润型特征的不典型肿瘤细胞。这是否存在一些未知的临床意义?换句话说, 仍不能确认这到底是原位癌还是浸润型癌。
(3)未进行识别主要组织学类型的验证实验。尤其是如何使伏壁样区别于其他浸润类型, 如腺泡样及乳头状?
(4)符合MIA诊断标准的肿瘤, 若浸润成分以实体性、微小乳头状为主, 或若出现巨细胞及梭形细胞成分但又不符合多形性癌的诊断, 也有100%的无疾病生存率吗?
(5)对于完全切除的单发黏液性MIA的长期随访结果如何?这种类型可能是多灶性浸润型黏液性腺癌的初期表现吗?
(6)微小乳头状类型在晚期和早期病例中是否都意味着较差的预后?
(7)若侵袭性微小乳头状或实体性成分不代表主要的类型而以相对少量的形式出现, 是否存在预后意义?或它们占多少比例才有意义?
(8)EGFR突变特异性抗体免疫组化法能否成为一种可靠的EGFR突变检测方法?
(9)通过在小活检或细胞学标本中进行免疫组化检测完善NSCLC-NOS的诊断是否有价值仍未定论。尚需开展全身治疗的临床研究对其进行评估。
(10)鳞状细胞癌或腺癌分化的其他标志物, 如鳞状细胞癌的desmocoglein-3或desmocollin或腺癌的天冬氨酸蛋白酶-A, 需进行进一步的评估。
(11)病理科医师仍难以根据冰冻切片区分AIS与浸润型病灶。
(12)目前, 我们仍不能推荐任何明确的分级系统。需更多的研究以确定最佳的分级系统是否应包括组织结构、细胞核评估或两者的结合。
(13)在转移灶的标本中, 识别主要的组织学类型是否具有临床意义?
一些重要的临床因素影响着腺癌新分类:(1)病理类型为腺癌是晚期非小细胞肺癌患者接受培美曲塞治疗疗效的重要预测因子。(2)把鳞癌从腺癌和其他非小细胞肺癌区别处理的另一重要原因在于, 鳞癌患者接受贝伐单抗治疗可能导致致命的大咯血。(3)在晚期肺腺癌患者一线治疗中, EGFR突变可作为接受EGFR-TKI治疗后无进展生存率(progression-free survival, PFS)和缓解率的预测因子。(4)分子标志物是肺腺癌评估和治疗过程中需要重点关注的领域。除了EGFR突变之外, 还需要更多数据证实KRAS突变、EGFR基因拷贝数、EML4-ALK融合基因等分子标志物的价值。
完成最初的评估之后, 还需要通过侵入性的检查明确诊断和分期。活检部位的选择原则是以风险最低的方式获得尽可能多的疾病信息。选择活检方式的关键因素在于是否能够获得足够的肿瘤组织, 以利于进行必要的病理学和分子标志物评估(如突变状态分析和免疫组化)。
对于含有实性成分的外周型结节, 经胸活检是可行的有创性诊断方法, 如CT引导下活检、支气管镜/导航辅助的支气管镜、亚肺叶切除或肺叶切除术(如电视辅助胸腔手术或剖胸探查)。空心针组织活检或细胞穿刺活检后富集细胞块均可获得足够的肿瘤组织。如果涉及纵隔内病灶, 可通过支气管针吸活检术(TNBA)进行盲检或超声支气管镜引导(EBUS)的TNBA、超声食管镜(EUS)引导的FNA、经颈从隔镜、经胸骨旁纵隔镜或电视辅助胸腔镜手术(video-assisted thoracic surgery, VATS)。对于复发的患者, 再次活检不仅可确诊, 还可以获得分子标志物的信息。
9.1.1 预后和预测因子
研究人员正致力于明确临床、病理学、分子生物学等因素与患者疾病结局之间的相关性。为了便于讨论, 我们将这些相关因素分为两类, 预后因子和预测因子。虽然严格意义上两者均为预后因素:预后因子反映了疾病本身的严重程度(如疾病进展和复发), 预测因子是与患者接受特定治疗疗效相关的因素。预测因子和预后因子具有部分重叠, 但在多数情况下两者还有一定的区别。
肺腺癌患者最主要的独立临床预后因子包括分期、体能状态评分、年龄和性别。无论是临床分期还是病理学分期, 疾病分期均可作为独立的预后因子。另有数据显示, 吸烟史也可作为独立的预后因子。
虽然临床因素可提供重要的预后信息, 但随着对疾病认识的深入, 与特定治疗相关的预测因子正受到越来越多的关注, 最初引起注意的是组织学类型。在厄洛替尼和吉非替尼的前期临床试验中, 疗效良好的患者通常为具有沿肺泡壁生长趋势的肺腺癌患者(原来的BAC)。这促成了诊断为BAC的患者接受吉非替尼和厄洛替尼治疗的临床试验。West等报道了西南肿瘤协作组临床试验的结果, 其中吉非替尼的有效率为17%。同样, Miller等报道厄洛替尼治疗BAC或具有BAC特征的肺腺癌患者可获得22%的有效率。在新的分类中, 这类肿瘤被认为是具有不同程度沿肺泡壁生长特性的浸润性腺癌。
虽然组织学类型仍然是重要的预测因子, 但是最近发现EGFR突变状态与吉非替尼和厄洛替尼治疗效果的相关性之后, 可预测疗效的分子标志物越来越受到重视。研究人员早在20年前已经发现NSCLC患者中存在KRAS突变, 但是其作为临床预后和预测分子的价值一直存在争议。而对于EGFR, 多项Ⅱ 期临床试验证实了该基因存在突变可作为接受吉非替尼和厄洛替尼治疗的预测因子。东亚裔、少量或无吸烟史的患者EGFR突变率较高。最具临床意义的EGFR突变为21外显子的L858R突变和19外显子框内缺失突变。在仅入组肺腺癌患者或以肺腺癌患者为主的四项Ⅲ 期临床研究(其中一个按临床因素选择患者, 另三个选择EGFR突变患者)显示, 与传统含铂双药方案化疗相比, EGFR突变的肺癌患者接受EGFR抑制剂吉非替尼临床疗效较好(有效率和PFS)。在IPASS研究中, 分子学亚组分析显示PFS获益仅见于EGFR突变的患者[风险比 (hazard ratio, HR) 0.48, 95%可信区间(confidence interval, CI)0.36~0.64], 吉非替尼治疗对EGFR野生型患者反而有害(HR 2.85, 95%CI 2.05~3.98)。Maemodo等提示, EGFR突变的患者中, 吉非替尼和紫杉醇联合卡铂方案相比有效率更高 (73.7% vs. 30.7%, P< 0.001), 吉非替尼的PFS为10.8个月, 紫杉醇联合卡铂方案的PFS为5.4个月(HR 0.30, 95%CI 0.22~0.41, P< 0.001)。Mitsudomi等提示, EGFR突变患者接受吉非替尼治疗的PFS明显延长(9.2个月vs. 6.3个月, HR 0.489, 95%CI 0.336~0.710, P< 0.001)。Zhou等的研究显示, 与接受吉西他滨/卡铂相比, EGFR突变患者接受厄洛替尼治疗的PFS较长(13.1个月vs. 4.6个月, HR 0.16, 95%CI 0.10~0.26, P< 0.000 1)。但这些临床试验均未观察到吉非替尼一线治疗在提高总生存时间方面的优势, 这可能是由于二线治疗时患者接受了厄洛替尼或吉非替尼交叉治疗。同样, 在吉非替尼对比多烯紫杉醇方案的Ⅲ 期研究(INTEREST)中, EGFR突变的患者接受吉非替尼治疗后PFS比EGFR基因野生型患者更长, 客观缓解率较高(42% vs. 7%)。除此之外, 多项Ⅱ 期临床试验可证实EGFR突变可作为接受TKI治疗后PFS和缓解率的预测因子。
研究人员同样也关注其他分子标志物在厄洛替尼和吉非替尼治疗中的预测价值。对ISEL研究进行的回顾性分析显示, EGFR基因拷贝数和蛋白表达可作为吉非替尼治疗后总生存期的预测因子。加拿大BR.21研究(随机、安慰剂对照厄洛替尼治疗NSCLC的Ⅲ 期研究)的多因素分析(通过对种族、功能状态评分、体重减轻、吸烟史、既往治疗、既往治疗疗效进行均衡后)数据显示, EGFR基因拷贝数(而不是EGFR突变)与较短的生存期(HR 1.9, 95%CI 1.1~3.4)和较高的有效率 (P< 0.005)相关。但在对比吉非替尼与多烯紫杉醇二线治疗的Ⅲ 期研究(INTEREST)显示, 两组患者的总生存期相似, 患者所接受的治疗与EGFR基因拷贝数、蛋白表达、突变状态之间无相互作用。这三个临床试验的结果可能受到入组了大量非腺癌患者的影响, 但仍有一定的探索性意义。
对于晚期NSCLC而言, EGFR突变检测较基因拷贝数和免疫组化对于预测EGFR-TKI治疗有效率和疗效具有更大价值。在一项关于厄洛替尼治疗的Ⅱ 期研究中, 对分子标志物的多因素分析显示, EGFR突变而不是基因拷贝数可预测患者接受厄洛替尼治疗的有效率, 突变患者有效率为83%, 无突变患者有效率为7%(P< 0.01)。在这项研究中, 免疫组化结果无法预测有效率。另一项由Sholl 等进行的研究显示, EGFR突变状态可预测TKI治疗后的缓解率和PFS, 而FISH、CISH或免疫组化则无法预测。目前已经开发出针对EGFR外显子19缺失突变和L858R突变的特异性抗体, 但这一检测的临床意义需在将来的临床试验中进一步验证。IPASS研究发现, FISH+的患者如果无EGFR突变, 吉非替尼的疗效较化疗差。所有这些临床试验均按RECIST标准评价疗效。
最近, 研究者发现除了鳞癌以外的所有NSCLC患者都可能从以下两种药物中获益, 培美曲塞具有良好的疗效, 而贝伐单抗毒性反应较少。然而, 这些亚组分析大多存在一定的缺陷。培美曲塞是一种多靶点的抗叶酸药物, 在非鳞癌NSCLC(腺癌和NSCLC-NOS)中具有良好的抗肿瘤活性, Ⅲ 期临床试验显示腺癌患者从其治疗中获益的比例更高。一项Ⅲ 期临床试验中, 对比了培美曲塞/顺铂与吉西他滨/顺铂, 预设的亚组分析显示腺癌患者的中位生存期明显延长(12.6个月 vs. 10.9个月, HR 0.81, 95%CI 0.71~ 0.99, P=0.03), 大细胞癌患者(目前可被称为NSCLC-NOS)的总体生存期也较长(10.4个月 vs. 6.7个月, HR 0.67, CI 0.48~0.96), 但对所有鳞癌和含鳞癌成份的混合癌患者培美曲塞组并未显示生存获益。针对上述试验中未出现3或4度毒性反应的随访分析显示了类似的结果, 培美曲塞/顺铂与吉西他滨/顺铂的中位生存期分别为5.6个月 vs 2.8个月(HR 0.64, 95% CI 0.56~0.72, P< 0.001)。Ciuleanu等进行的培美曲塞对比安慰剂的Ⅲ 期临床中的组织学类型亚组分析显示, 腺癌患者的PFS (4.5个月 vs. 1.5 个月, HR 0.511, CI 0.38~0.68, P< 0.000 1)和中位生存期(16.8个月 vs. 11.5 个月, HR 0.73, CI 0.56~0.96, P< 0.026)均明显延长。在非鳞癌(其他)和非鳞癌(总体)的患者中同样获益明显, 而在大细胞癌或鳞癌患者中则无获益。多项Ⅱ 期临床试验显示培美曲塞可使非鳞癌NSCLC得到治疗获益。然而, 最近的一项以生活质量作为主要观察终点的Ⅲ 期研究中, 无论何种组织学类型患者均可从培美曲塞联合卡铂治疗中获益。腺癌或NSCLC-NOS(组织学非鳞癌)是唯一经证实可从贝伐单抗联合铂类获益的患者。事实上, 由于鳞癌患者发生不良反应的危险性较高, FDA已禁止鳞癌患者接受贝伐单抗治疗, 但是这类患者可入组正在进行的辅助治疗临床试验。
最近, 在NSCLC患者中发现了一种新的预测标志物, EML4/ALK融合基因突变。这一改变可导致肿瘤基因ALK结构激活。最近的一项研究纳入82例确诊存在ALK融合基因(FISH)NSCLC患者的研究显示, Crizotinib(PF02341066, 一种ALK和MET的抑制剂)的总体有效率达到57%, 估计的6个月PFS率为72%。目前已有报道在ALK抑制剂治疗过程中新出现EML4/ALK激酶域的耐药性突变。
9.1.2 组织学和分子标志物检测的临床意义
准确的组织学分型和EGFR突变检测对治疗方案的选择具有重要的指导意义, 应被纳入晚期肺腺癌患者初治的诊断内容中。然而其他EGFR相关检测(如免疫组化和FISH)和/或KRAS突变的作用尚不明确。除了EGFR突变以外, 其他目前正在探索中的分子标志物的价值也许能在将来的临床研究中得到证实。
9.1.3 可手术切除的NSCLC
仅20%~30%Ⅰ 期~Ⅲ A期NSCLC患者可接受手术切除治疗。接受手术治疗的患者基于病理分期具有不同的预后。最新的IASLC分期显示患者的5年生存率Ⅰ A期为73%, Ⅰ B期为58%, Ⅱ A期为46%, Ⅱ B期为36%, Ⅲ A期为24%, Ⅲ B期为9%。含铂辅助化疗方案可使患者的治愈率提高5%。27%Ⅰ A期和42%Ⅰ B期NSCLC患者最终将复发而死于肺部肿瘤; 但目前没有准确的方法来预测哪些患者的预后较差, 且易于复发。同样, 41%Ⅱ 期NSCLC患者可通过手术切除肿瘤而治愈, 不需要接受任何辅助治疗。因此, 研究人员迫切需要找到合适的因素帮助我们选择患者接受辅助治疗。Ⅲ 期辅助治疗随机对照研究的回顾性分析已发现有几种可预测辅助化疗疗效的分子标志物。例如, DNA修复基因ERCC1低表达预示着含铂化疗疗效较好, 虽然这一结果仍有待进一步验证。已有的数据显示, 手术切除肺腺癌标本中组织学亚型不同的患者生存期存在巨大差异, 将来组织学类型可能会在选择辅助治疗患者中发挥作用。
对于晚期肺腺癌患者, 我们推荐检测EGFR突变(强推荐, 中级质量证据)。
提示:强烈推荐本项检测是由于接受该检测的潜在获益明显优于其风险。基于EGFR-TKI治疗的Ⅲ 期临床试验和多个试验的亚组分析结果, 准确检测EGFR突变状态与患者临床获益显著相关, 可预测治疗后的有效率和PFS, 但对于预测患者生存期无意义。
如果计划进行分子标志物检测, 合理的活检方法将有助于提供足量的标本以进行病理学诊断和分子标志物分析, 需注意务必正确处理标本以利于检测。
(1)组织学类型和/或分子分型在评估患者预后和优化治疗方法选择上起到怎样的作用?
(2)在确定预后或预测因子方面, 组织学类型与分子学类型孰轻孰重?在取材方法中, 基于少量活检组织和细胞标本还是手术标本?
(3)使用EGFR突变特异性抗体的免疫组化方法是否可行?
(4)在晚期肺腺癌患者中, 使用组织学与免疫组化(如TTF-1和/或p63)联合的方法来进行病理诊断与目前临床常用的传统光学显微镜检测相比, 其最终诊断的组织学类型对预后和治疗的指导意义是否有所不同?
(5)肺腺癌转移灶与原发灶相比, 分子标志物或组织学特征上差异的临床意义。
(6)非吸烟肺腺癌患者其临床、流行病学、分子学和组织学特征。
目前已发现多种与肺腺癌患者相关的重要分子标志物:(1)EGFR突变状态对晚期肺腺癌患者接受EGFR-TKI一线治疗后的PFS和有效率具有预测意义。(2)EGFR突变肿瘤显示出相对惰性的发展过程。(3)EGFR突变与KRAS突变相互排斥并独立存在。(4)EGFR/KRAS突变阴性者更有可能检测到EML4-ALK融合基因。
正常肺组织在解剖学上分为两个部分, 通气系统和参与气体交换的外周肺实质。在初始的胚胎肺芽形成之后, 形态上重复出现分叉最终形成交通气道和终末肺泡囊和肺泡。在后期, 常规的TTF-1在所有外周肺上皮细胞(如细支气管和肺泡)中表达。在某些肺腺癌中TTF-1是一个潜在的细胞谱系中表达的致癌基因。外周细支气管肺泡部分(终末细支气管、肺泡管、肺泡)也包含两种潜在肿瘤细胞起源, Clara细胞和Ⅱ 型肺上皮细胞, 这两类细胞最终组成终末呼吸单位(terminal respiratory unit, TRU), 并导致肿瘤表达TTF-1。而中央气道(支气管)包含两种潜在可导致肿瘤的祖细胞:支气管基底细胞和黏液细胞。这些肿瘤均为TTF-1阴性并在CT上显示为实体占位。基于表达谱的分层聚类分析将肺腺癌分为TRU相关和非TRU型腺癌, 这两种腺癌亚组均具有独特的组织发生起源。
肺腺癌可能经历从AAH到AIS到侵袭性肿瘤的渐进过程, 并由多种基因改变导致恶性表型所触发, 但是目前这仅是一种假说。虽然从最早的正常肺上皮和AAH到浸润性腺癌, 均存在EGFR与KRAS突变。EGFR基因拷贝数改变则更多出现在肿瘤后期具有侵袭性和转移性时。EGFR、KRAS和TTF-1扩增是这一进展阶段的特征。与非浸润性腺癌相比, p53基因突变在浸润性腺癌中更为常见。然而, p53突变并未成为一个可靠的预后因子或治疗靶点。
对于DNA突变的高通量分析使肺腺癌分子学特征展现出新的面貌。在188例肺腺癌样本中, 对623个已知癌相关基因进行的DNA测序发现了1 013种突变。除了确证已知的抑癌基因p53、P16INK4和STK11/LKB1, 新发现NF1和RB1突变(发生率各为10%)。另有两个重要发现:(1)突变频繁发生在酪氨酸基因家族中, 如EGFR、KRAS、ERBB4、EPH44、EPH3、KDR和FGFR4, 并可作为酪氨酸抑制剂的靶点。(2)某些基因之间存在突变的排他性, 如EGFR/KRAS、EGFR/STK11、NF1和p53/ATM。突变频率显示腺泡样腺癌、乳头状腺癌和BAC与LRP1B、p53和INHBA突变无相关性。然而, 这些突变与实体肿瘤亚型之间存在显著正相关(表5)。
| 表5 腺癌组织学亚型与分子学、放射学的联系 |
许多文献研究了肺腺癌中KRAS和EGFR改变的流行病学规律(表5)。EGFR突变的发生率在亚裔、从未吸烟、非黏液性腺癌中较高, 大约10%~30%, KRAS突变则在非亚裔人群、吸烟和浸润性黏液腺癌中较常见, 比例也占10%~30%。EGFR突变主要影响酪氨酸结构域中的ATP结合区。最常见的突变通常导致EGFR第858位框架氨基酸由亮氨酸变为精氨酸和外显子19的框内缺失。有报道认为EGFR突变状态与AIS、LPA、乳头状和微小乳头状腺癌亚型明显相关, 在其他肿瘤组织学亚型出现较少(表5)。一项大型研究纳入了806例NSCLC标本, 显示EGFR突变与BAC或存在BAC特征的腺癌(可能包括AIS、MIA和LPA)相关, 而另一项对97例肺腺癌病理的回顾分析显示两者不存在相关性。有研究认为实体性成分为主的亚型肿瘤与KRAS突变明显相关, 但并非所有研究均能证实这一观点。V600E BRAF突变的发生率小于5%, 且其与乳头状腺癌、微小乳头状腺癌及浸润性肺腺癌的伏壁样成分均具有相关性。另有关于其他少见BRAF突变的报道, 如1例存在V599E突变的高分化腺癌(无亚组信息)和2例存在11外显子(G465V)和15外显子(L596R)错义突变(无组织学亚型)。
表5总结了目前与肺腺癌相关的主要分子学特征。组织学亚型和分子学、生物学特征具有高度相关性的唯一实例是浸润性黏液腺癌(原称黏液性BAC)通常存在KRAS突变且缺乏EGFR突变。大多数此类肿瘤的TTF-1表达为阴性, 它们可能来源于细支气管黏液杯状细胞, 因此可能表达MUC 2-5-6。
EGFR突变是EGFR-TKI治疗的特异性靶点, 且基于3个Ⅲ 期临床试验和多个Ⅱ 期试验, 可作为预测TKI疗效的分子标志物(详见临床推荐部分)。目前EGFR外显子19缺失和L858R突变特异性抗体检测EGFR突变状态, 较早前的抗体显得更为可靠, 但是这种抗体的预测作用也需要进一步在临床试验中得到证实。特殊的获得性EGFR突变, 如T790M、其他的MET基因学改变(扩增)、ERBB3(过表达)和外调蛋白(自分泌环激活), 占TKI耐药机制约50%。
一小部分肺部肿瘤存在染色体2p倒位, 导致EML4-ALK融合基因转化。在激酶域中未发现活化的突变; 但融合蛋白的二聚体化可导致其活化。EML4-ALK融合基因在肺腺癌中的发生率为5%。年轻、男性、从未或少量吸烟患者发生此类改变的机会较大。已报道ALK易位和多种组织学特征相关, 包括腺泡样、乳头状、筛状成分、黏液素产物(细胞质内和细胞质外)和印戒细胞成分。
其他组织学类型如鳞癌和黏液性表皮样肿瘤是否存在EML4-ALK易位目前尚存争议。检测EML4-ALK易位有一定的技术含量, 目前的方法包括免疫组化、FISH和反转录聚合酶链反应等。免疫组化需要使用抗体, 且与EML4-ALK易位的相关性好, 因此可作为筛查的手段。多数存在EML4-ALK易位的肿瘤为TTF-1表达阳性, 且可能p63也为阳性。EML4-ALK易位与EGFR和KRAS突变均独立存在, 且p53突变的发生率较低。在肺腺癌中, 最近发现了另一种包括KIF5B-ALK融合的ALK易位; 而且, 目前的数据不足以明确它的组织特异性本质。在接受ALK抑制剂治疗的过程中, 有报道EML4-ALK激酶域可出现获得性耐药性突变。
除了组织学评估之外, 肿瘤mRNA基因组可为研究发病机制、患者预后和疗效预测提供重要补充信息。无校正聚类分析显示三类不同的腺癌与肿瘤形态和肺发育通路相关。Beer 等的研究显示属于这三类范畴内的肿瘤与分化、分期和形态(定义为细支气管起源或伏壁样形态)相关。Borczuk 等的研究显示浸润性特征与侵袭性强的肿瘤类型相关。这三种类型包括非浸润性和微小浸润型肿瘤(≤ 5 mm)、混合浸润性和伏壁样成分的肿瘤、实体浸润性癌。 Motoi 等的研究说明这三类肿瘤与原BAC、实体肿瘤、乳头状亚型分别高度相关。Takeuchi 等证明表达一定特征的腺癌亚型与形态学和正常肺发育通路相关。形态学分析提示具有两种分类, 包括TRU型腺癌(以伏壁样成分和TTF-1表达、表面活性蛋白为基础)和非TRU腺癌(缺乏上述特征)。TRU肿瘤可进一步分为TRU-a和TRU-b。功能分析显示TRU肿瘤保留着正常外周肺分化的特征, 与之相对应的是, 非TRU肿瘤与细胞周期和基因增殖富集相关。
虽然EGFR突变在乳头样为主的腺癌和TRU-a中较常见, KRAS突变则在实体肿瘤和TRU-b型肿瘤中常见, 癌基因突变状态并不是基因表达特征和分子分型的主要决定因素。综合而言, 通过无校正聚集分析法定义了三种形态学各异的肺腺癌, 包括(1)AIS和MIA; (2)浸润性非实体腺癌; (3)浸润性腺癌, 实体为主型。因此, 这些分子特征可为基于对伏壁样成分和其他成分(包括实体成分)的评估而建立的新分类方法提供生物学解释。
最近, Bryant等使用了来自于Shedden等的肺腺癌基因表达数据和完整的病理学资料, 检测27个已知癌症相关通路与腺癌亚型、临床特征和患者生存的相关性。采用腺癌非校正聚集和基因表达富集分析法证实三种主要聚类和细胞增殖状态是将肿瘤分为不同亚型的最主要途径。而且, 细胞增殖较强的腺癌其预后明显较差, 且实体成分增多。而与非实体成分的肿瘤相比, 包含任何实体成分的肿瘤患者生存较差。特定的组织学亚型、基因表达通路和聚类具有明显的相关性, 其中一些见表5。用相同的分析方法对两组独立的肺腺癌组(来自日本, N=87; 来自法国, N=89)进行分析后也得出了具有一致性的结果。
肿瘤mRNA将是预测患者接受手术治疗后是否获益的重要指标。基于方法学上的进展(包括独立有效性), 目前已发现数个预测因素。考虑到可作为预测因子和包含每种特征的特定基因数量, 这些研究的结果具有一定的异质性。这一异质性可为试验设计、分析平台、肿瘤组织学类型和患者选择提供不同的选择。一个在442例腺癌样本中进行的大型、多中心、盲法研究评估了8种独立来源的预后基因组特征, 相对于单纯使用基因表达, 加入临床因素共变量可增强这些特征的作用。基于100个基因簇的相关表达预测患者预后的方法优于其他方法。与细胞增殖有关的545个基因组成的基因簇相对高表达时, 患者预后相对较差。这一研究建立起一种模式, 将有助于解决XX癌基因组学研究中面临的一些困难, 也有利于处理临床和病理学的大量信息。对这些特征预测准确性的独立回顾性评估、前瞻性临床研究、小活检样本的应用将进一步拓展这一研究领域。
已有多项研究采用评估DNA基因拷贝数的方法来区分不同的腺癌亚型。Avielronen等使用比较基因组杂交的方法对腺癌亚型进行了全面分析, 对比原BAC与具有原BAC特征的浸润混合型腺癌, 后一类腺癌中的大多数在新分类中被定义为伏壁样生长为主的浸润性腺癌。可检测到多种特异性的染色体改变, 如在原BAC和伏壁样生长的腺癌中的1p、2q、5p、7p、11p、11q、12q、16p、16q、17q、20q和21q。虽然这两种亚型具有类似的染色体改变, 伏壁样生长的浸润性腺癌其染色体改变的变异性更大, 发生率更高, 且染色体发生改变和缺失的片段更长。伏壁样生长腺癌中缺失突变更为常见, 主要见于3p和5q以及4q和6q中的较少部分。原BAC的基因组学特征看上去与伏壁样生长的浸润性腺癌有所区别, 后者的基因组学变异更为明显。这表明从原BAC到伏壁样生长的侵袭性腺癌, 在基因组学水平上已有明显不同。
Weir等发现肺腺癌中最常见的点扩增见于染色体14q13.3, 其发生率为12%, TTF-1(亦被称为NKX2-1)即存在于此区域中。Barletta等检测了TTF-1基因扩增和组织学的相关性, 在49例腺泡样、乳头状和实体亚型中有6例具有TTF-1扩增, 而原BAC肿瘤中则未发现该基因扩增。
Hirsch等使用FISH方法检测EGFR基因拷贝数, 发现FISH法检测的EGFR基因拷贝数与原BAC和伏壁样生长的晚期腺癌患者接受吉非替尼治疗疗效相关。Cappuzzo等认为EGFR突变与扩增之间具有较强的相关性。Conde等的研究提示原BAC和乳头状腺癌患者突变发生比例更高。Chang等使用CISH方法发现TKI治疗有效率与EGFR突变状态以及腺癌形态学明显相关, 但与EGFR基因拷贝数升高仅有弱相关性。其他研究亦报道了类似的结果, 但是腺癌亚型与EGFR拷贝数改变之间的关系仍无定论。Motoi等采用CISH方法率先对此问题进行了研究, 但未发现腺癌亚型与EGFR扩增存在高度相关性。
研究人员对进展期腺癌进行了EGFR拷贝数分析, 认为EGFR突变先于拷贝数异常出现, 原发灶EGFR拷贝数异质性与转移病灶相比也更为明显。EGFR扩增与组织学高分级和/或浸润性生长相关, 而少见于癌前病变AAH和原BAC中。因此, 具有如上改变的肿瘤侵袭性更强。Zhu等应用多因素Cox模型分析发现, EGFR基因高拷贝既是一个不良的预后因子(HR 1.93, CI 1.09~3.44, P< 0.025), 也是厄洛替尼治疗后生存延长的预测因子(HR 0.33, CI 0.15~0.71, P< 0.005)。MET扩增可能是导致厄洛替尼耐药的作用机制。 Zudaire等在较小诊断样本量中采用了FISH分析法, 结果显示90%的石蜡包埋空心针穿刺活检样本可进行EGFR和c-MET的FISH分析。这些研究提示即使肿瘤取材量有限, 拷贝数分析仍可能检测EGFR扩增, 从而为评估预后提供必要的信息, 也可以检测MET扩增以解释EGFR-TKI耐药的原因。然而, EGFR突变对EGFR-TKI的预测意义仍大于基因扩增。
包括DNA微卫星分析、CGH、DNA突变测序、免疫组化和基因表达分析在内的技术方法已被用于区分肺内转移和多原发肺癌。由于少量的活检标本即可用于检测, 因此这些方法的应用范围得到很大拓展, 但还没有达到预期的效果, 在常规临床实践中的地位还有待进一步确立。然而, 这些技术对于区分多发肺腺癌结节是肺内转移还是多中心起源提供了新的有效手段, 从而有利于肿瘤准确分期、判断预后和制定合理的治疗策略。
肺腺癌的原发灶和转移灶在形态学和分子标志物的表达方面都具有明显的差异; 但是, 这一问题仍需进行更深入的研究。转移灶与原发灶, 不同转移灶之间, 其突变状态可以是相同的或不同的, 所以更需要采用多学科综合治疗。目前关于EGFR突变的数据大多数来自于诊断时的肿瘤组织样本(原发瘤或转移灶), 而不是在使用EGFR抑制剂前的活检组织。
过去20年, 研究人员一直在努力寻找与患者预后相关的分子标志物。已有Meta分析报道关于EGFR、TTF-1、p21ras、HER2、p53、Ki67、BclⅡ 和环氧化酶2作为免疫组化标志物的预测作用。除了EGFR、p21ras和环氧化酶2之外, 其余免疫组化标志物表达与患者预后的相关性均存在统计学差异。然而, 这些因素与风险度(HR 1.13~1.57)之间仅有弱相关性。
Meta分析提示, 虽然p53或KRAS基因突变对预后的影响具有统计学意义, 但其预测作用较弱, 并不足以在临床中推广应用。与之相比, 基于两项回顾性观察研究的结果, EGFR突变的肺腺癌患者不论是接受EGFR-TKI治疗, 还是接受手术治疗的预后均优于野生型患者。
(1)需进行更多关于基因拷贝数差异、基因组学和蛋白组学标志物与临床和病理学差异的相关性研究。
(2)需进一步深入研究EML4-ALK融合基因, 特别是在EGFR/KRAS突变阴性的患者中。
(3)我们推荐以后的分子标志物研究应基于完善的临床和病理数据库, 并参照本文的分类进行腺癌的诊断。
(4)目前关于MicroRNA与腺癌亚组分型相关性的资料较少, 需进一步评估MicroRNA的作用, 以确定它们是否有助于肺腺癌风险分层和疗效预测。
(5)需进行联合基因组学和蛋白组学的研究以判定它们是否可为NSCLC和腺癌提供更准确的亚组分型, 为不同腺癌亚型的危险因素分层、预后预测和治疗选择提供更精确的信息。
在CT检查中, 有许多术语可用于描述肺腺癌。特别是表现为小结节的肿瘤, 这些术语用于反应各种GGO改变(非实体性)、实体性或部分实体性。其大多基于Fleischner协会术语表和最近Godoy和Naidich为亚实体结节推荐的指南, 我们提出了如下定义:(1)纯GGN(非实体结节)为局灶性的肺组织衰减, 血管的边缘轮廓等正常结构仍然清晰可见。(2)实体结节:病灶区域密度衰减值增加, 以至于正常结构如血管完全被掩盖。(3)部分实体结节(半实体结节):病灶区域不透明并包含了实体和毛玻璃样成分。Fleischner协会术语表将CT胸部显影的结节定义为“ 一个圆形或不规则的不透明区, 边界清楚或不清楚, 最大径小于3 cm。如果不透明区大于3 cm, 则称之为团块。最大径小于3 cm是病理学诊断AIS和MIA的上限。放射学诊断也经常用到亚实体结节这一术语, 涉及部分实体结节和纯GGN。评估亚实体性结节的最佳方法是通过薄层CT(≤ 3 mm层厚)鉴别实体和毛玻璃样成分。
AAH是薄层CT检出肺腺癌最早期的侵袭前病灶, 表现为范围较小(≤ 5 mm)的GGN(图11)。AAH的特征表现为十分模糊的纯GGN, 通常小于5 mm。AAH中的纯GGN可为单发或多发。
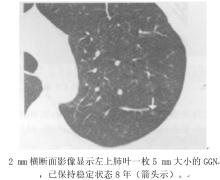 | 图11 浸润前病变(AAH或AIS)的CT表现 |
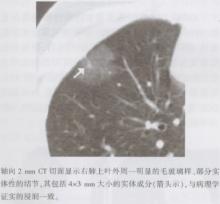
AIS在CT(最好是薄层CT)中可得到最佳显影, 有时在胸片上亦可看到。非侵袭性病灶和非黏液性AIS表现为典型的纯GGN(图12), 但有时也可表现为部分实体或实体结节。AIS可为空泡样改变。黏液性AIS表现为实体性结节或强化(图13)。与薄层CT中AAH的黯淡模糊表现相比, AIS的纯GGN通常为衰减值轻度升高的稍高密度结节。AIS可单发也可多发。
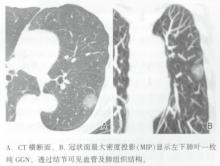 | 图12 2 cm大小的周围型非黏液性AIS的CT表现 |
 | 图13 原位黏液性腺癌的CT表现 |
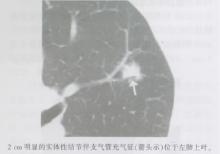
MIA的影像学表现多样, 至今还没有完整的描述, 但非黏液型在薄层CT中的影像表现可暂且描述为主要包括毛玻璃成分和中心实体成分, 最大径小于5 mm的部分实体性结节(图14)。黏液性MIA(图14)较非黏液性MIA少见, 通常表现为实体或部分实体性结节。AAH、AIS和MIA的影像学表现存在一定差异。
 | 图14 非黏液性微浸润型腺癌(MIA)的CT表现 |
放射学推荐1
当肺腺癌中的阴影为纯GGN或部分实体性结节伴毛玻璃样成分为主时, 我们建议不再使用BAC作为专业术语。这类肿瘤应使用新的术语进行分类, 如:AIS、MIA及LPA(强推荐, 低级质量证据)。
浸润型腺癌通常为实体性结节(图15), 但也可为部分实体性(图16), 偶尔为GGN。可发生GGO的肺叶改变(图17)。Ⅰ A期腺癌中的空泡征或囊样透亮可以被认为与高分化肿瘤及缓慢生长有关。增厚的(≥ 2 mm)毛刺征与淋巴结转移、血管侵犯及术后生存期较短有关。对于表现为部分实体性结节的Ⅰ A期腺癌, 广泛的毛玻璃样成分提示预后良好。毛玻璃样成分通常对应于组织学上的伏壁样生长类型, 实体性成分对应于浸润型。形成支气管充气征通常表示分化程度高。无胸膜凹陷亦是一种提示Ⅰ A期腺癌预后良好的征象。在实体性腺癌中, 切迹或压迹出现在薄层CT上与组织学上的低分化及不良的治疗结果有关。
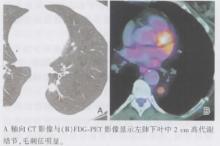 | 图15 浸润型腺癌的CT及FDG-PET表现 |
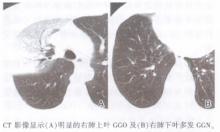 | 图17 非黏液性伏壁样为主型腺癌的CT影像 |
浸润型黏液性腺癌, 之前称为黏液性BAC, 结节的特征性影像学表现为一系列包括GGO、混合性GGO/实体性病灶或实变在内的肺叶改变, 但肺泡内黏液可能在CT上表现为实体性或接近实体性(图18与图19)。这种黏液样成分在CT显影表现的密度类似于软组织, 低于肌肉组织。在静脉给予碘化造影剂后, 血管可以十分清晰地成像(CT血管造影征)黏液性及非黏液性浸润型腺癌的影像学特征可发生重叠。
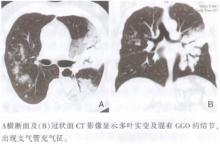 | 图18 浸润型黏液性腺癌的CT影像 |
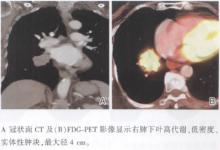 | 图19 浸润型黏液性腺癌的CT及FDG-PET影像 |
放射学推荐2
对于典型的浸润型腺癌, 之前被归为黏液性BAC, 我们建议将其从非黏液性腺癌中单列出来, 并归为浸润型黏液腺癌(强推荐, 中级质量证据)。
注意:此类占位的CT显影通常表现为实体性或绝大部分为实体性, 常可见支气管充气征, 呈单叶或多叶分布, 通常由多发结节或实变样阴影构成(之前称为多中心BAC)。
典型的AAH生长十分缓慢, 最大径通常≤ 5 mm, 但在极少数病例中可达12 mm。通常认为, 最大径小于5 mm的纯GGN癌变机会极小而无需随访, 但更大的GGN 进行CT检查随访的最佳频率及持续时间仍不明。
AIS大小各异, 但绝大多数在2 cm之内, 而且生长十分缓慢。疑似GGN的病灶如直径≥ 5 mm则需定期随访, 至少每年进行一次CT检查。病灶增大或实变是可能进展为侵袭性疾病的征象。对于最大径超过10 mm的病灶, 建议更密集的随访频率, 每6个月至1年复查一次CT。然而, 至今所有对于疑似GGN的推荐指引均是基于小样本观察性研究而制定的, 因此还需要对这些指引进一步评估。
MIA尚无法根据影像学检查明确定义, 部分归因于其组织病理学定义困难且关于其大小及生长速度所知甚少, 但绝大多数的MIA小于2 cm。浸润性肺腺癌的大小及生长率各异, 但对于小于2 cm的腺癌而言, 肿瘤越小, 侵犯血管的可能性越小。腺癌的大小可以预测中枢神经系统转移的可能性, 对于最大径2~6 cm、无淋巴结转移的腺癌, 有报道显示, 肿瘤最大径2 cm者中枢神经系统转移的概率为0.14, 而6 cm者直线上升至0.72。
对于CT发现的疑似肺癌孤立性结节, 由Fleischner协会推荐的随访方案现已被广泛接受。然而, 正如Godoy及Naidich所指出的, 这些指南并未专门针对GGN及部分实体性结节。
由于许多CT上发现的疑难肺部病灶往往体积很小, 故如何测定其结节的大小尤为重要。CT扫描设备、扫描窗的设置、读片者间及读片者自身行为的差异十分常见, 可严重影响对肿瘤大小的评估, 尤其是在肺部结节的CT随访过程中。
多灶性肺腺癌并非罕见, 高达8%~22%的手术切除及18%经筛查发现的病例表现为多中心起源肺腺癌。多原发肺腺癌可发生于AAH、AIS及浸润型腺癌中(图20)。根据信号衰减的相似程度可判断伏壁样或实体性成分的相对百分比。亚实体性结节很少有转移的现象。
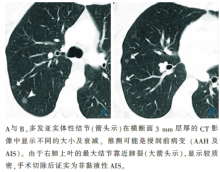 | 图20 AIS/AAH的多中心GGN的CT影像 |
氟脱氧葡萄糖正电子发射体层成像(fluorodeoxyglucose positron emission tomography, FDG-PET)中标准化摄取值(standardization value is taken, SUV)的升高与细胞的增殖及原发灶的侵袭性有关(图15和图19)。PET检测AIS的敏感性通常很低。PET通常用于浸润型腺癌的分期及随访, 对于7 mm或更大的病灶, 肺腺癌的SUV通常比其他组织学类型的肺癌更低, 与生存期呈负相关。已有的研究显示PET在评估化疗的疗效时比CT更准确, 但仍需进一步的研究。排除了病灶大小的影响之后, 在黏液性与非黏液性腺癌之间未发现两者SUV值存在显著差异。对氟脱氧葡萄糖亲和力较弱的(如最大SUV< 2.5)的高分化小腺癌而言, PET随访并评估SUV值变化的价值有限。
已有多项研究报道了核磁共振在鉴别小AIS、混合性浸润型腺癌/AIS及浸润型腺癌中的作用。在Ohno等及Tanaka等的研究中, 对于鉴别AIS/伏壁样为主(原称为BAC)与浸润型腺癌, 其敏感度分别为86%及97%, 特异度分别为100%及77%。
影像学引导下经皮肺穿刺活检, 无论是通过针吸还是空心针穿刺, 都使从极少的标本中获得分子学信息成为可能。
(1)当肺腺癌的阴影为纯GGN或部分实体性结节伴毛玻璃成分为主时, 我们推荐不再将BAC作为专业术语使用。这类肿瘤应使用新的术语进行分类, 如:AIS、MIA及LPA(强推荐, 低级质量证据)。
(2)对于典型的浸润型腺癌, 之前被归为黏液性BAC, 我们建议将其从非黏液性腺癌中独立出来, 归为浸润性黏液腺癌(强推荐, 中级质量证据)。
注意:此类占位在CT上通常为实体性, 常可见支气管充气征, 呈单叶或多叶分布, 并通常由多发结节或实变样阴影构成(原称为多中心BAC)。
(1)进行活检的放射科医师应尽量获取足够的组织, 不仅可用于传统的显微镜分析, 还可用于免疫组化及分子学分析。
(2)薄层CT技术应当运用于部分实体性病灶的检查, 以记录实体成分的范围以及整个肿瘤的大小, 包括实体性及毛玻璃样成分(图16)。
(3)肿瘤在形状、大小及显影信号衰减的变化有助于明确随访时间以及决定何时干预。
(1)什么是单发或多发GGN的自然病程?这些病灶的浸润性转变频率仍未阐明。
(2)如何测量肿瘤的大小:单一最大直径, 二维面积, 还是体积?对于部分实体性病灶应测量整个病灶及实体成分的大小, 因为仅凭实体成分的大小预测预后仍证据不足。部分实体性病灶中实体成分的测量亦需与浸润成分的组织学评估相结合。应采用薄层CT以追踪小肺腺癌的病灶大小随时间发生的改变。在放射科医师测量结节大小的过程中存在的读片者间与读片者自身的差异仍是需关注的问题。体积测量法有益于更精确评估模糊结节的大小变化, 但人机误差, 包括对实体成分的鉴别, 仍是诊断小GGN需面对的问题(图17B)。
(3)如何定义CT衰减值和肺腺癌新分类中不同亚类的关系?CT柱状图分析提示衰减特征在AAH、AIS及MIA中可能不同。定量分析这类病灶的相关研究正在进行中。
(4)如果在多发肺腺癌中对每一个结节衰减特征(如毛玻璃对比实体性成分的相对范围)进行详细描述, 是否与全面的组织学分型一样有助于病理学诊断, 并明确结节是肺内转移还是多中心起源?
(5)CT筛查可在肿瘤自然病程的早期发现小病灶, 这种新的分类方法将会对CT筛查有何影响?医学及经济上的成本/效益问题也是当前的一个研究方向。
(6)分子学检测能否与一系列肺腺癌的放射学类型相联系?仅少量研究试图将影像学及分子学分析联系在一起。已有报道认为EGFR突变与超过50%的GGO、小于3.5 cm的病灶及PET显像中高SUV水平的晚期疾病相关。另有报道认为Ki-67与PET显像中高SUV水平及肿瘤的失分化相关。
肺腺癌的新分类方法, 尤其是AIS及MIA概念的引入, 给外科治疗提出了新的问题, 包括早期肺癌是否可行亚肺叶切除术, 胸部CT在选择适用亚肺叶切除术患者中的作用, 处理这类病灶的具体外科方法, 淋巴结清扫的范围, 冰冻切片诊断的作用及多发小肺癌的治疗, 而这些问题现在尚无明确答案。
在新分类中特别定义AIS及MIA的主要原因之一是为了解决以下问题:出现单发小病灶时, 是否可通过CT显像中的GGO形态预测这类病变?局限性切除术对这类病灶是否有效?CT上表现为实体性的2 cm或更小的肿瘤, 通常认为是具侵袭性的, 肺叶切除术目前仍是标准的外科治疗方法。近来, 许多回顾性研究显示亚肺叶(局限性)切除术对于早期肺癌患者是合适的外科治疗, 但仍没有随机临床试验证实。已有两项相关的临床试验(日本临床肿瘤组的JCOG0802和北美开展的CALGB140503)正在试图回答这一问题。在这两项研究中, CT表现为GGO的患者被随机分组, 分别接受肺叶切除术或亚肺叶切除术, 这一现状能否改变将取决于试验的最终结果。绝大多数关于肺叶切除术及亚肺叶切除术治疗2 cm或更小肿瘤的报道在生存期或局部区域复发方面均未显示出差异。有报道示CT上表现为GGN(GGO)的肿瘤完全切除术后的5年无疾病生存率100%。
病灶位置(周围或是中央)、影像表现(毛玻璃样或是实体性)和肿瘤大小(T1a对比T1b对比T2)等重要因素均会影响亚肺叶切除术的可行性。CT影像, 尤其是通过薄层高分辨率CT扫描获得的影像, 在评估这类因素影响时必不可少, 而且最近的研究显示影像与病理学之间也存在密切的联系。最近有关CT影像为GGO与组织病理学诊断相关性的研究中, 这类病灶多数对应于肺癌浸润前、非浸润型或肿瘤生长的早期病变。
多项研究提示对于临床Ⅰ 期的非小细胞肺癌而言, 接受电视辅助胸腔镜手术(video-assisted thoracoscopic surgery, VATS)的肺叶切除术患者和通过开胸术行肺叶切除术的患者在总生存期方面未见差异, 而且通过VATS手术的患者并发症发生率似乎更低。VATS是目前周围型肿瘤肺楔形切除术的标准方法; 而VATS肺段切除术仍未广泛普及, 其价值需进一步评估。
为了使局限性切除术成为合适的肿瘤治疗, 明确术前及术中诊断是至关重要的。术中决定小肺癌是否存在浸润成分的冰冻切片分析的准确性有待进一步提高。冰冻切片预测值为93%~100%, 但不是所有文章都明确报道冰冻切片分析的准确性。
由冰冻切片评估肿瘤边缘可能存在一定的问题, 尤其是当两侧都使用过自动吻合钉时, 已有报道尝试刮擦或冲洗装订线后再进行细胞学分析。行亚肺叶切除术时, 对于叶间、肺门或其他可疑淋巴结进行冰冻切片分析有助于分期, 如发现淋巴结阳性, 只要患者心肺功能可耐受, 建议行肺叶切除术。
进行系统性肺门纵隔淋巴结清扫术是因为有研究报道大约20%的≤ 20 mm的肺腺癌与5%的 ≤ 10 mm的肺部病灶已存在淋巴结转移。肺叶特异性的淋巴结清扫术, 即清扫范围仅限于收纳受累肺叶的主要淋巴引流区域, 已显示出替代完全性系统淋巴结清扫术的趋势。一项新近报道的多中心前瞻性临床试验将术中分期为T1-2N0无肺门N1的NSCLC患者随机分组, 分别接受淋巴结采样术或系统性淋巴结清扫术, 结果显示在3.8%接受系统性淋巴结清扫术的患者中发现隐匿淋巴结转移, 但无总生存期方面的获益。最新的研究亦显示在非常早期腺癌的某些特殊类型中, 尤其是GGO病灶, 通常不需要行系统性淋巴结清扫术。但是这些结果不应类推至相对晚期的患者中。
如果没有纵隔淋巴结侵犯, 多灶性肺腺癌的多发结节不是外科治疗的禁忌证。由于需考虑多种因素:不同结节的数目及大小、同期对比异时病灶、单侧对比双侧、原发对比转移病灶及特殊类型(AAH、AIS及MIA), 目前尚未制定多发病灶的标准治疗流程。
(1)由于缺乏前瞻性随机临床试验的结论, 局限性切除术的最佳适应证仍未确定。
(2)淋巴结清扫术的范围仍存争议。
(3)冰冻切片评估浸润型腺癌的准确性及在亚肺叶切除术中评估切缘的准确性需进一步提高, 应制定冰冻切片分析的具体指南以指导术中决策。
(4)多发病灶的治疗仍无标准。
新的肺腺癌分类需采取特殊染色及分子学技术, 但部分没有免疫组化或分子学数据的患者同样需要治疗决策, 这种情况可能发生在某些技术资源有限的地区, 或无法取得特殊检测所需的额外组织标本的医疗中心。这一章节简要归纳了在这种情况下如何应用这种分类方法。
在无分子学、免疫组化或组织化学检测的情况下, 肺腺癌的诊断及亚型分类均可仅凭光学显微镜评估而做出。
13.1.1 手术切除标本
两种特殊染色可能有助于对手术切除的肺腺癌标本进行进一步的诊断分型, 一是黏蛋白染色有助于大细胞癌的鉴别, 二是NE标志物有助于诊断LCNEC。在前一种情况下, 若腺癌呈现单纯的实体性类型, 不伴有腺泡样、乳头状或伏壁样类型, 则有时胞质内的黏蛋白可在HE染色中显示。若未发现, 则此肿瘤应被归为大细胞癌, 但应考虑到其他不可能完成的特殊染色。如果非小细胞癌的形态学呈现出NE表现且不能进行NE免疫组化标志物检测, 则此肿瘤应被归为大细胞癌伴NE形态, 并做具体的注释, 即此肿瘤可能为LCNEC, 但标本无法通过免疫组化证实此诊断。
13.1.2 小活检及细胞学检查
对于小活检, 若腺样或鳞状上皮分化清晰可见, 则此肿瘤可被分别归为腺癌或鳞状细胞癌。若存在一定程度的不确定性, 则应当如此描述:低分化非小细胞癌, 倾向为腺癌(或鳞状细胞癌), 并做注释(无法进行特殊染色, 此诊断仅凭光学显微镜做出)。若未见腺样或鳞状上皮分化的形态学特征, 则此肿瘤应被归为低分化NSCLC-NOS。
若诊断是在缺乏特殊检测技术的情况下做出的, 则对肺腺癌患者的评估应当保持一致。
胸部CT检查范围应尽可能扩展至肾上腺及肝脏, 以对此类患者做出放射学评估。在技术资源有限的情况下, 胸部X线检查可能发现肺原发癌、胸腔积液、淋巴结或骨转移; 然而与CT相比, X线检查的分辨率低得多, 因此为了明确诊断及肿瘤分期, 尽可能进行一次胸部CT检查。
如果在技术资源缺乏的情况下, 患者今后有可能进行分子学或免疫组化研究的检查, 应妥善保管组织标本。
对于缺乏如EGFR或KRAS突变状况等分子学信息的肺腺癌患者, 可根据肿瘤、淋巴结及转移的情况进行(TNM)分期, 再进行手术或化疗等治疗方案的选择。
肺腺癌新分类法对于TNM分期意义重大, 并将影响今后对TNM分期的修订。关于AIS、MIA及LPA等概念的改变与当前的乳腺癌分类标准及术语相似, 但不适用于其他组织学类型的肺癌。此外, 在此分类中用以评估浸润型腺癌的全面组织学分型方法为多发腺癌的分期提供了参考依据。
(1)AIS将被归入原位癌。然而, 由于肺鳞状细胞癌及腺癌都可能发生原位癌(carcinoma in situ, CIS), 故诊断应明确为原位癌(鳞状细胞癌)或原位癌(腺癌), 其类似于乳腺癌的原位癌分为导管CIS 及小叶CIS。
(2)类似于微浸润乳腺癌, 其被定义为最大径小于或等于1 mm病灶的浸润性癌, MIA将被归为T1mi, 不同之处在于T1mi的最大径小于或等于5 mm。
(3)亦类似于乳腺癌, 不是根据包括浸润及伏壁样或原位癌成分在内的整个肿瘤的大小, 而是仅根据浸润成分的范围作出的原位腺癌或伏壁样为主型腺癌的T分期可最准确地预测预后。在早期肿瘤中, 肿瘤大小的T因素由测定整个肿瘤的大小转变为仅测定浸润成分的范围。采用放射学及病理学的方法, 对比整个肿瘤大小(CT上GGO加上实体性成分对照病理学上浸润成分和原位/伏壁样成分)与仅实体性或浸润成分范围(分别通过CT及病理学检查测得)对于生存期的影响。
(4)对于多发肺腺癌, 全面的组织学分型有助于鉴别肺内转移及伴发或异时原发性肿瘤。分子学检测在这种情况下的作用值得期待, 但仍需进一步的研究。
未来的5年中, 这些新的概念将在早期及晚期肺腺癌的患者中不断验证, 如果实践证明有用, 其中一些概念将会出现在第8版TNM分期中。
[文献来源:Travis WD, Brambilla E, Noguchi M, et al. J. Thorac Oncol, 2011, 6(2):244-285.]
The authors have declared that no competing interests exist.