作者简介:
高青云(1994-),女,湖北孝感人,硕士研究生,主要研究方向为肺癌靶向及免疫治疗。
目的 目前,关于鳞状细胞肺癌(squamous cell lung cancer,SqCLC)患者驱动基因突变的频率和最佳治疗方案存在争议。本研究的目的是分析该人群中的突变状态和不同治疗方案的疗效。方法 选择2019年9月1日至2021年9月25日在广东省肺癌研究所确诊的局部晚期和晚期SqCLC患者。对所有接受基因检测的患者进行突变状态和疗效的回顾性分析。采用肿瘤患者来源的类器官(patient derived organoid,PDO)进行药敏实验,应用多重免疫组织化学(multi-immunohistochemistry,mIHC)初步探索肿瘤免疫微环境(tumor immune microenvironment,TIME)。结果 EGFR、 ALK、 MET、 HER2和 RET的突变频率分别为7.8%、1.1%、1.2%、0.6%和0.6%。在21例驱动基因突变阳性患者中,共有14例患者接受了一线酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)治疗,客观缓解率(objective response rate,ORR)为42.9%。第三代TKI在 EGFR突变患者中的ORR为80.0%。药敏试验为靶向治疗的潜在益处提供了证据。此外,mIHC结果显示驱动基因突变阳性SqCLC患者中巨噬细胞和NK细胞的不同浸润特征。结论 靶向治疗对具有驱动基因突变阳性的局部晚期和晚期SqCLC患者有一定的疗效。同时,TIME与该人群靶向治疗和免疫治疗疗效之间的相关性值得探讨。
Objective At present, there are controversies regarding the frequency and optimum treatment regimen of oncogenic driver mutations in squamous cell lung carcinoma (SqCLC) patients. This study aimed to analyze the mutation status and the efficacy of different treatment regimens in this population.Methods Patients with locally advanced and advanced SqCLC diagnosed at the Guangdong Lung Cancer Institute from September 1, 2019, to September 25, 2021, were selected. A retrospective analysis of mutation status and efficacy was performed on all patients who underwent gene detection. To verify and explore the basis for the efficacy of different therapies, drug susceptibility tests using patient-derived organoids and multi-immunohistochemistry (mIHC) were conducted.Results The mutational frequencies of EGFR, ALK, MET, HER2and RET were 7.8%, 1.1%, 1.2%, 0.6% and 0.6%, respectively. Among the 21 patients with oncogenic driver mutations, a total of 14 patients received first-line tyrosine kinase inhibitors (TKIs), with an objective response rate (ORR) of 42.9%. The ORR of 3rd-generation TKIs in patients with EGFRmutations was 80.0%. Drug susceptibility tests provided evidence for the potential benefit of targeted therapy. Additionally, the mIHC results indicated the different infiltrating characteristics of macrophages and NK cells in SqCLC patients with oncogenic driver mutations.Conclusions Targeted therapy does have certain benefits in locally advanced and advanced SqCLC patients with oncogenic driver mutations. At the same time, the correlation between the tumor immune microenvironment and the efficacy of both targeted therapy and immunotherapy among this population is worth exploring.
肺癌是世界上发病率和死亡率最高的恶性肿瘤[1]。据Molina等的研究[2], 约85%的肺癌新诊断病例属于非小细胞肺癌(non-small cell lung cancer, NSCLC), 其中肺腺癌(lung adenocarcinoma, LUAD)和鳞状细胞肺癌(squamous cell lung cancer, SqCLC)是最常见的组织学亚型, 分别占50%和30%[3]。近年来, 由于高通量生物技术的快速发展, 一系列与NSCLC相关的驱动基因被发现。这些基因赋予细胞选择性生长的优势, 并“ 驱动” 它们导致恶性肿瘤的发生, 被称为驱动基因[4]。驱动基因的发现, 加上基因检测的成熟和靶向药物的开发, 已经彻底改变了晚期NSCLC的治疗策略。
一些临床试验表明, 针对这些驱动基因的抑制剂已经取得了令人鼓舞的疗效。表皮生长因子受体(epithelial growth factor receptor, EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)等酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)在LUAD患者中获得了较高的客观缓解率(objective response rate, ORR)和延长的生存期[5, 6, 7, 8, 9, 10]。与LUAD相比, SqCLC的驱动基因突变率较低。因此, 针对SqCLC的TKI治疗也很少[11]。此外, 与使用TKIs治疗的EGFR突变阳性腺癌[无进展生存期(progression-free-survival, PFS)为8~12个月(month, m)]相比, SqCLC患者的疗效略低(PFS为5m)[12]。SqCLC中潜在的靶向基因或通路改变, 如EGFR扩增已被报道, 但尚未被转化为有意义的临床效果[13]。其他的治疗方案, 特别是免疫治疗方案, 仍然缺乏对具有驱动基因突变的SqCLC的探索。因此, 对驱动基因的突变率、不同治疗方法的疗效和基线肿瘤免疫微环境(tumor immune microenvironment, TIME)进行全面的回顾性分析是必要的。
在本研究中, 我们回顾性分析了局部晚期和晚期SqCLC患者的EGFR、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)、V-RAF鼠类肉瘤病毒癌基因同源物B1(V-RAF murine sarcoma viral oncogene homolog B1, BRAF)、Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rats arcomaviral oncogene homolog, KRAS)、ALK、间质-上皮细胞转化因子(mesenchymal epithelial transition factor, MET)、神经营养蛋白受体激酶(neurotrophic tyrosine receptor kinase, NTRK)、转染重排(rearranged during transfection, RET)和C-ROS癌基因1(c-ros oncogene 1, ROS1)[14]的突变率以及患者的临床特征。随后, 我们观察不同治疗方案对这些患者的疗效, 为未来的临床治疗提供了潜在的证据。
本研究选取2019年9月1日至2021年9月25日在广东省肺癌研究所确诊的所有局部晚期和晚期SqCLC患者。回顾性分析相关驱动基因患者的临床和病理资料, 包括年龄、性别、分期和诊断时的基因状态。临床分期是根据美国癌症联合委员会第八版的分期进行定义。本研究排除了原发性腺鳞癌或转移灶为腺癌的患者。本研究经广东省人民医院伦理委员会批准(伦理号:GDREC2019217)。
所有患者的病理诊断均经广东省人民医院病理科的组织病理学和免疫组化(immunohistochemistry, IHC)证实。结果由两位专门病理学家独立解释。通过定义肿瘤细胞中程序性死亡配体1(programmed death ligand 1, PD-L1)阳性细胞的比例来评估PD-L1(22C3 pharmDx; Agilent Technologies Inc., Santa Clara, CA, USA)的表达。肿瘤细胞中PD-L1阳性表达定义为≥ 1%, 而阴性表达定义则相反。
主要使用燃石和世和二代基因测序(next generation sequencing, NGS)检测患者肿瘤组织基因突变状态(包括EGFR, ALK, RET, ROS1, HER2, BRAF, KRAS, MET, NTRK)。此外EGFR突变也通过突变扩增阻滞系统(amplification refractory mutation system, ARMS)(AmoyDx, 厦门, 中国)检测。同时也采用IHC抗ALK抗体(Ventana, D5F3, Gift of Cell Signaling Technology, Beverly, MA)检测ALK突变。根据既往研究, HER2和MET扩增也通过荧光原位杂交(fluorescent in situ hybridization, FISH)检测[15, 16]。
在整个队列中, 接受靶向药物治疗的患者最初每4周通过常规CT扫描进行评估。如果患者的病情没有进展, 则将评估的持续时间调整为每2个月一次。具体根据实体肿瘤(Response Evaluation Criteria in Solid Tumor, RECIST)1.1版进行疗效评估。PFS的定义是从靶向治疗的开始到肿瘤进展的日期或最后一次随访。
样本取自患者恶性胸腔积液(malignant pleural effusion, MPE), 并无菌保存于肝素化(10 U/mL)无菌瓶中在4 h内以低温(2~8℃)送往实验室。类器官培养的确切过程是按照前面描述的类似方案进行的[17]。将样本在112 rcf下离心3 min, 并用红细胞裂解液裂解。取沉淀物并用HEPES缓冲液(Thermo Fisher Scientific)清洗。将细胞重悬于Accuroid肺癌培养液(ALCM; Accurate International Biotech Co. Ltd)中并细胞计数。随后将200 μ L Matrigel(Corning Inc.)加入到100 μ L细胞悬液中以建立类器官, 并吸取30 μ L混合物滴入预热的6孔板中, 37 ℃条件下固化30 min。凝胶化后, 每孔加入3 mL ALCM。每隔2~3天更换一次培养液。
收集培养超过2周的类器官, 使用1× TrypLe试剂(Thermo Fisher Scientific)分离。将分离的类器官混合在MBM(membrane-bottomed microwell)+Matrigel(1:1)中。置于冰上种植到384孔白板上。凝胶化后, 每孔加入30μ L MBM, 培养48 h。类器官的平均直径被设定为50 μ m作为药物筛选的最低要求。设置了6个加药浓度, 5倍稀释的浓度梯度(50、10、2、0.4、0.08和0.016 μ m)。同时设置等浓度安慰剂作为阴性对照组。加药后第3~4天后使用CellTiter-Glo细胞活力检测仪(Promega)检测细胞活力值。使用GraphPad Prism 7.0(GraphPad Software, La Jolla, CA, USA)软件计算半数最大抑制浓度(half-maximal inhibitory concentration, IC50)值。
使用panO7-plex IHC试剂盒(Panovue, Beijing, China)将厚度为5μ m的福尔马林固定石蜡包埋切片用于mIHC染色, 包括CD8、CD56、CD68、HLA-DR和PANCK染色如前所述, TIME的细胞亚群由mIHC鉴定[18]。
所有统计分析均采用SPSS 26.0软件(SPSS, Inc., Chicago, IL, USA)进行评估, P值< 0.05被认为有统计学意义。
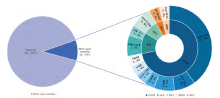
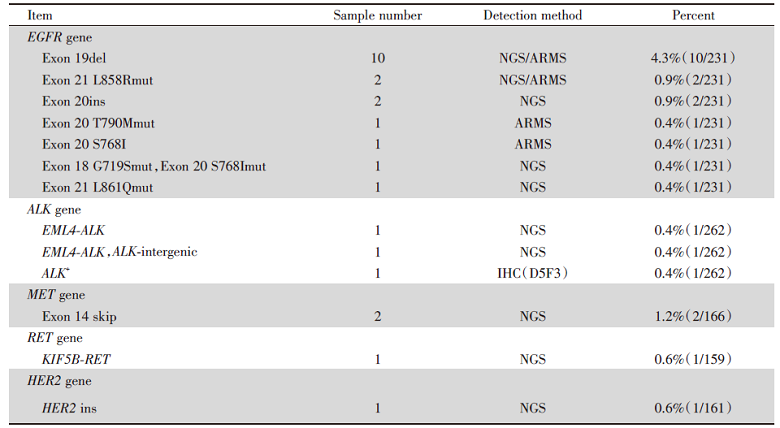
如图1所示, 266例进行相关驱动基因检测, 共25例有驱动基因突变。EGFR、ALK、MET、RET和HER2的基因突变率分别为7.8%(18/231)、1.1%(3/262)、1.2%(2/166)、0.6%(1/159)和0.6%(1/161)。KRAS、ROS1、BRAF和NTRK均未观察到突变。在18例EGFR突变患者中, EGFR第19外显子缺失最常见(10例, 40%), 其次是EGFR第21外显子L858R(2例, 8%), EGFR第20外显子插入(2例, 8%), EGFR第20外显子T790M(1例, 4%)。其他驱动基因突变, 如L861Q、G719S和S768I(各1例, 4%)。2例MET突变的患者均为MET第14外显子跳跃突变。在ALK突变的患者中, 有2例患者发生了EML4-ALK融合。另一例患者采用IHC检测, 因此具体融合类型未知。另外2例驱动基因阳性的患者为KIF5B-RET融合和HER2插入。患者具体基因突变状态及相应检测方法见表1。
| 表1 敏感驱动基因突变状态结果 Tab.1 Result of sensitive driver gene mutation status |
我们分析了25例驱动基因突变阳性的患者, 其中男性11例, 女性14例。Ⅲ 期患者7例, Ⅳ 期患者18例。6例患者有吸烟史, 19例患者无吸烟史。有吸烟史的患者EGFR突变率为83.3%(n=5), 无吸烟史的患者EGFR突变率为68.4%(n=13)。ALK融合患者3例, 其中男性2例, 女性1例。MET突变患者2例, 其中男性1例, 女性1例。另外, RET融合1例, HER2插入1例, 均为女性。大多数患者的肿瘤标志物在基线时出现异常(n=20, 80.0%)。在有MET突变的患者中, 肿瘤主要为外周型(n=2)。其余基因在不同性别、年龄组、吸烟史、TNM分期或肿瘤标记物之间的突变频率均未观察到显著性差异, 见表2。
| 表2 驱动基因阳性晚期SqCLC的临床特征总结 Tab.2 Summary of clinical characteristics of advanced SqCLC with positive sensitive driver gene |
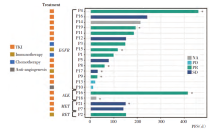
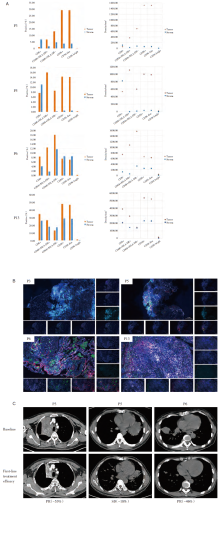
除参与临床试验的4例患者外, 最终纳入驱动基因突变阳性患者21例。20例接受治疗的患者(95.2%)中, 14例(70.0%)接受了一线TKI, ORR为42.9%, 而2例患者的疗效无法评估。7例患者在最后一次随访日期前没有进展。所有患者的PFS如图2所示。在10例一线接受EGFR-TKI治疗的EGFR突变患者中, 5例接受了第一或第二代TKI, 5例接受了第三代TKI。此外, 第三代TKI的ORR为80.0%。化疗2例(10.0%), 其中单纯化疗1例, 同步放化疗1例。2例患者均达到部分缓解(partial response, PR)的最佳疗效, 但PFS分别仅为3.3m和5.5m。安罗替尼作为一种抗血管生成治疗药物用于1例患者(5.0%), PFS仅为0.4m, 最佳疗效为疾病进展(progression disease, PD)。还有3例(15.0%)患者接受了一线免疫治疗, 基因状态分别为KIF5B-RET、EGFR20exon、EGFR19del。PD-L1均呈低表达(PD-L1 < 50%)[19], 治疗方案分别为白蛋白紫杉醇+卡铂+帕博利珠单抗(albumin-bound paclitaxel + carboplatin + pembrolizumab, PCK)、紫杉醇+卡铂+纳武利尤单抗、白蛋白紫杉醇+卡铂+帕博利珠单抗。在这3例患者中, PR 2例, 疾病稳定(stable disease, SD)1例, 疾病控制率(disease control rate, DCR)为100%, ORR为66.7%。
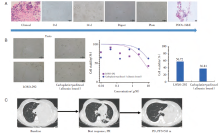
我们在2例患者中使用MPE培养了PDO。这2例病例在一线治疗进展后都进行了重新活检。我们在胸腔穿刺后立即收集MPE进行培养。其中, P2为KIF5B-RET融合的SqCLC患者, 一线治疗采用PCK方案治疗。P2的PDO用卡铂+白蛋白紫杉醇和LOXO-292进行药敏实验。IC50值分别为15.3和5.7, 抑制率分别为36.8%和56.7%。结果表明, 该患者在接受TKI治疗时的疗效可能优于化疗。随后P2患者二线接受LOXO-292治疗, 最佳疗效PR(-55%), PFS为4.3m。P16为EGFR L858R突变的SqCLC患者, 一线阿法替尼耐药后其PDO进行了阿法替尼和奥希替尼的药敏实验。结果表明, P16对第一代和第三代TKI均有一定的敏感性。但该患者在接受二线奥希替尼治疗1周后失访, 因此未进行临床疗效验证, 见图3。
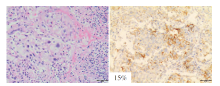
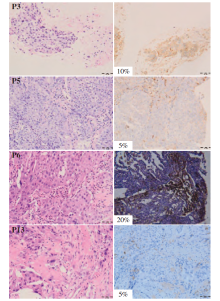
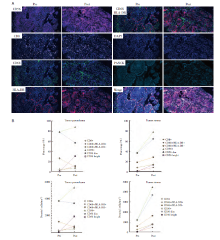
在经组织病理和质量评估后, 对5例驱动基因突变阳性SqCLC患者的基线石蜡包埋标本进行mIHC检测, 其中1例患者在一线免疫治疗前和二线靶向治疗后有组织标本。这5例患者PD-L1的表达水平均较低(< 50%), 见图4, 图5。
如2.4所描述的, P2为KIF5B-RET融合的SqCLC患者, 一线接受PCK方案治疗, 最佳疗效达到PR, PFS为5m[20], 然后接受RET-TKI作为二线治疗。基线和免疫治疗后组织的mIHC结果对比显示, 在表达阳性率方面, 肿瘤实质中M2和表达低水平CD56的NK细胞(NK cells expressing low levels of CD56, CD56dim)细胞的阳性率显著降低(26.36%~9.85%, 78.05%~57.11%), M1和表达高水平CD56的NK细胞(NK cells expressing high levels of CD56, CD56bright)细胞的阳性率升高(1.63%~11.95%、0.28%~30.95%), CD8细胞表达水平没有明显变化(4.95%~6.61%), 始终处于一个较高水平[21]。而在肿瘤间质中M2和CD56dim细胞的阳性率中则是升高的(18.33%~28.50%, 36.70%~64.36%)。同样, 我们也观察到了肿瘤实质和肿瘤间质中各细胞密度的上述变化, 见图6。
其余4例患者均未接受过免疫治疗。P3和P5为EGFR 19del患者。P3同时接受了化疗和放疗, 最佳疗效为PR, PFS为5.0m。P5一线接受奥希替尼靶向治疗, 但PFS仅为2.7m。两例患者肿瘤间质中CD8+T细胞的阳性率(分别为7.1%和11.1%)均高于肿瘤实质(分别为1.0%和7.7%), 肿瘤实质中M1、M2、CD56dim和CD56bright的阳性率和密度均高于肿瘤间质。P13为EGFR L858R突变患者, 一线接受阿法替尼治疗, PFS仅为0.7m, 肿瘤间质中M2细胞的阳性率(17.4%)高于肿瘤实质(13.2%), 其他细胞的阳性率和密度在肿瘤实质中均高于肿瘤间质。P6为ALK融合患者, 一线接受了阿来替尼治疗, 并在最后一次随访中仍然维持PR。在肿瘤实质(94.8%)和间质(100%)中CD56细胞几乎均为CD56dim。肿瘤间质中CD56dim的阳性率(8.6%)高于肿瘤实质(7.1%)。然而, 所有细胞的密度在肿瘤实质都高于肿瘤间质。此外, 这4例患者均显示, CD56bright细胞在肿瘤间质和肿瘤实质中的阳性率均小于5%, 见图7。
目前, SqCLC患者中致癌驱动突变的频率较低, 例如中国人群中LUAD和SqCLC中EGFR突变的频率分别为40.3%和4.4%[22], 与LUAD患者相比, 难以在具有致癌驱动突变的SqCLC患者中探索靶向治疗的疗效。若致癌驱动突变阳性, SqCLC患者是否应进行常规基因检测并接受TKI治疗也仍存在争议。
在我们的研究中, SqCLC患者EGFR的突变频率为7.8%(18/231), 这与既往的报道基本一致。据1项荟萃分析[23]报告显示, 东亚SqCLC患者EGFR突变频率略高于欧美SqCLC患者(4.6% vs. 3.3%), 而EGFR突变在中国人群中的突变频率要高得多, 范围为4%~20%[18, 24, 25]。对于伴有EGFR突变的SqCLC患者, 大多数突变发生在第19~21外显子上, 这在我们的研究中是一致的。此外, 我们还发现了1例EGFR 18外显子G719S突变合并20外显子S768I突变的患者。据Gou等[22]研究, 中国SqCLC患者中ALK的阳性频率约为2.0%。然而, 在我们的研究中, ALK的阳性频率仅为1.1%(3/262), 这可能是由于我们的研究样本量较小。此外, 对于伴有MET、HER2和RET突变阳性的SqCLC患者较少报道。
根据既往研究[26], 中国女性和不吸烟与SqCLC患者较高的EGFR突变率相关。本研究中, 有吸烟史的患者(n=5)EGFR突变率为83.3%, 无吸烟史的患者(n=13)EGFR突变率为68.4%, 但无显著差异。此外, 性别与EGFR突变率也无显著相关性。考虑本研究的样本量有限, 加上不同检测方法的差异, 可能是结果不一致的原因。年龄、分期、基线肿瘤标志物水平和肿瘤位置与EGFR突变率无关, 这与其他研究基本一致[25, 27]。
在治疗方案方面, 由于在以往的针对EGFR-TKI和ALK-TKI治疗相应驱动基因阳性NSCLC的Ⅱ 期/Ⅲ 期临床研究中, 较少纳入了携带EGFR/ALK阳性的肺鳞癌患者, 因而无法在这些临床试验中确定驱动基因阳性肺鳞癌患者使用EGFR-TKI和ALK-TKI的疗效。两项回顾分析关于EGFR-TKI治疗EGFR阳性肺鳞癌患者疗效的研究[28, 29]结果显示, EGFR阳性SqCLC的ORR为25.0%~31.8%, DCR为50.0%~81.8%, 中位PFS为1.9~5.0m。此外在既往个案报道[30]中, ALK-TKI治疗ALK融合SqCLC患者中位PFS可达7.1m, 提示其治疗效果可能与ALK阳性肺腺癌相近, 但由于样本量太小, 目前还不能完全肯定。在我们的研究中, 接受一线TKI治疗的肺鳞癌患者ORR为42.9%。此外关于免疫治疗是否能在驱动基因阳性NSCLC患者中发挥作用目前尚存争议, 全球多中心IMMUNOTARGET研究[31]是迄今为止规模最大的驱动基因阳性NSCLC患者应用免疫治疗的真实世界研究。大多数为肺腺癌患者, 仅2例SqCLC患者。一线使用免疫治疗药物只有5%患者。使用免疫治疗的总体治疗应答率为19%, 中位PFS为2.8m。在本研究中, 3例一线接受免疫治疗的SqCLC患者ORR为66.7%, DCR为100%。尽管相比于靶向治疗, 免疫治疗获益相对较小, 但并不排除免疫治疗的可能性, 因此提示TKI及免疫治疗在驱动基因阳性SqCLC患者中的潜力和有效性值得进一步探索, 同时也需要更多的临床试验来为驱动基因阳性SqCLC患者的个体化治疗提供令人信服的证据。
PDO作为一种三维临床前模型, 可能比其他体外模型更好地代表肿瘤的特征[32]。采用PDO的药敏试验已在一些研究中报道, 但其与临床相关性仍在探索之中。Kim等的一项研究[33]证实了来自晚期LUAD的PDO的临床相关性, 而来自SqCLC患者的PDO却鲜有报道。我们的研究在2例患者中进行了PDO药敏试验, 均显示对TKI敏感。对于P2的PDO药敏试验, 提示TKI的敏感性高于化疗, 并已通过临床疗效得到验证。虽然只有2例患者进行了PDO药敏试验, 其中1例(P16)缺乏临床疗效验证, 但体外试验仍初步证实了TKI对驱动基因突变SqCLC患者的益处。
此外很少有研究探索具有致癌驱动基因突变SqCLC患者基线TIME的特征。本研究对5例患者进行mIHC检测, 以探讨基线TIME的特征。虽然P2的CD8+T细胞在免疫治疗前后没有明显变化, 但CD8+T细胞的阳性率始终或接近于高水平(> 5%)。在肿瘤实质中, M2巨噬细胞的阳性率明显降低, 而在肿瘤间质中则明显升高。此外, 在肿瘤实质和肿瘤间质中, M1的阳性率均显著增加。Li等[34]认为, CD8+T细胞的高浸润水平和M2细胞的低浸润水平可能是免疫治疗的潜在预后和预测因素。在肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)中M1起到抗肿瘤作用, 而M2则促进肿瘤生长[35]。然而, 我们在巨噬细胞中的变化与一项在抗PD-L1应答的小鼠肺上皮细胞(货号:TC-1)宫颈肿瘤模型上进行的研究[36]不一致, 该研究表明, 将M2重编程为M1细胞和激活的抗原提呈细胞可以导致肿瘤对PD-L1阻断重新反应。对于NK细胞, 细胞毒活性较强的CD56dim占NK细胞的90%以上, 表达中等亲和力的白细胞介素-2受体(interleukin-2 receptor, IL-2R), 而CD56bright可产生大量的细胞因子, 主要发挥免疫调节作用, 高表达IL-2R[34, 37]。此外, NK细胞通常被认为具有治疗潜力, 特别是CD56bright[38]。然而, 在P2的肿瘤间质和实质中, CD56bright始终处于高水平。该患者中高水平的CD8+T和CD56bright的mIHC结果与免疫治疗后的临床反应一致。然而, 耐药后免疫细胞的变化与之前报道的LUAD不一致, 这可能是由于TKI干扰引起的。此外, 这也可能表明了SqCLC患者的独特性, 特别是那些具有致癌驱动突变的患者。
正如Qu等[39]报道的, 免疫细胞在LUAD和SqCLC之间存在显著差异, 如M2和活化的NK细胞在LUAD较高, 而M1和静息的NK细胞在LUAD较低。在我们研究中其他4例进行mIHC检测患者中, 3例显示肿瘤间质中CD8+T细胞浸润水平较高(> 5%)。这也可以进一步解释, TIME富含来自免疫细胞的趋化因子[40], 从而提示了免疫治疗的可能性。然而, 这4例患者的CD56bright浸润水平均较低。一些对EGFR或ALK突变NSCLC患者的研究[41, 42, 43]显示, PD-L1抑制剂的ORR水平较低, 但对TKIs耐药后PD-L1水平较高。mIHC结果初步提示, 免疫治疗可能在未来有利于这类患者, 为进一步探索具有致癌驱动突变的SqCLC患者的免疫治疗提供了证据。
由于我们的研究样本量小, 只有2例患者进行了PDO药敏试验, 同时未进行基因验证。如果将来有更多的患者和可获得的组织样本, 应该添加更多的数据来支持我们的研究结果。此外, 患者来源的PDO模型也应进行基因检测, 以确保其基因组的一致性, 而药敏试验的结果也将更好地指导临床用药。同样, 只有5例患者接受了mIHC检测, 因此无法进一步探讨TIME中细胞浸润与靶向治疗或免疫治疗疗效之间的相关性, 以及具有不同致癌驱动突变的SqCLC患者中TIME的特异性差异。有必要进行更多更大样本量的研究来重点关注靶向治疗和免疫治疗对具有致癌驱动突变晚期SqCLC患者的疗效。
综上, 本研究初步分析了本中心真实世界中驱动基因阳性晚期肺鳞癌患者的突变率、不同治疗疗效、肿瘤免疫微环境特征。本研究的不足在于这是一项单中心的回顾性分析, 样本量较小, 可能存在选择偏倚。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|